
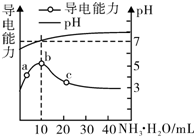
 常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )| A. | HR为强酸 | |
| B. | 加入10 mL 氨水时,溶液中c(NH4+)>c(R-) | |
| C. | c点溶液存在c(NH4+)<c( R-) | |
| D. | b点的离子浓度大于a点的离子浓度 |
分析 A.根据图象可知,a~b点导电能力增强,说明HR为弱电解质,在溶液中部分电离,加入氨水后生成强电解质,离子浓度增大;
B.b点溶液pH=7,此时加入10mLHR,HR与一水合氨的浓度、体积相等,则二者恰好反应;
C.c点时溶液的pH>7,混合液显示碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-);
D.溶液的导电能力与离子浓度有关,离子浓度越大,导电能力越强.
解答 解:A.a~b点导电能力增强,说明反应后溶液中离子浓度增大,证明HR在溶液中部分电离,为弱酸,故A错误;
B.体积图象可知b点溶液pH=7,此时HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,铵根离子与R-的水解程度相等,则溶液中c(NH4+)=c(R-),故B错误;
C.根据图象可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),故C错误;
D.溶液的导电能力与离子浓度有关,b点导电能力强,说明b点的离子浓度大于a点的离子浓度,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较、溶液导电性及其影响等知识,题目难度中等,明确酸碱混合的定性判断及溶液酸碱性与溶液pH的计算方法为解答关键,试题侧重考查学生的分析、理解能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器中NH3的物质的量一定增加了0.30mol | |
| B. | 容器中H2O(g)的物质的量至少为0.45mol | |
| C. | NH3的平均反应速率为0.010mol/(L•s) | |
| D. | NH3、O2、NO、H2O的物质的量之比一定为4:5:4:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
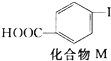 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$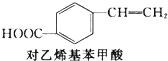 +HI
+HI| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
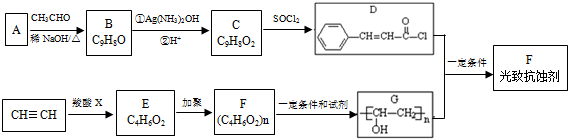
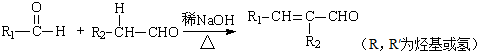
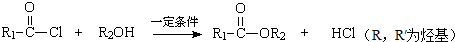
 .
.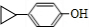 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质变化 | 能量关系 | |
| A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
| B | 将NaOH溶液与HCl溶液混合 | 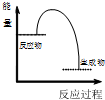 |
| C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
| D | 合成氨:N2(g)+3H2(g)?2NH3(g)+92.4kJ | 反应物的总键能>生成物的总键能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | A中试剂 | B中试剂 | C中液体 |
| I | 饱和食盐水 | 电石 | H2O |
| II | 浓氨水 | NaOH固体 | CCl4 |
| III | 生铁 | H2O | |
| IV | NaOH溶液 | 镁铝合金 | H2O |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ | B. | NH4+ | C. | SO42- | D. | S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| B | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变成黄色 | 氧化性:H2O2>Fe2+ |
| C | 将溴乙烷与NaOH的乙醇溶液共热,将生成的气体直接通入KMnO4酸性溶液中 | KMnO4酸性溶液褪色 | 乙烯使KMnO4酸性溶液褪色 |
| D | 向a、b两支盛有KI3溶液的试管中分别加入淀粉溶液、硝酸银溶液. | a试管中溶液变蓝 b试管中产生黄色沉淀 | KI3溶液中存在平衡I3--?I2+I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| B. | CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com