
(14分)铜是与人类关系非常密切的有色金属。已知:常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+ =Cu2++Cu。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为: ,某同学实验时却有黑色物质出现,这种黑色物质的化学式为: 。
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:
a.2Cu2++4I- =2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I- =2CuCl↓(白色)+I2。
为顺利观察到白色沉淀可以加入的最佳试剂是 。
A.SO2 B.苯 C.NaOH溶液 D.乙醇
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH)。
①已知NH5是离子晶体且所有原子都达到稀有气体的稳定结构,请写出NH5的电子式: 。
②写出CuH在过量稀盐酸中有气体生成的离子方程式 。
③将CuH溶解在适量的稀硝酸中, 完成下列化学方程式

(4)常温下,向0.20 mol ? L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=________________mol.L‑1。
[已知:
 ]
]
(14分)(每空2分)(1)砖红色,CuO (2) B (3) ①
②2CuH + 2H+ ==Cu +Cu2+ + 2H2 ↑ ③6、16、6、3、4NO、8H2O 2.2×10-4
【解析】
试题分析:(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热发生氧化还原反应生成氧化亚铜、葡萄糖酸和水,因此生成不溶物的颜色为砖红色。氧化亚铜不稳定容易转化为黑色的氧化铜,因此这种黑色物质的化学式为CuO。
(2)为顺利观察到白色沉淀,则需要把碘萃取出来,所以可以加入的最佳试剂苯,答案选B。
(3)①已知NH5是离子晶体且所有原子都达到稀有气体的稳定结构,这说明该离子化合物是由H-和铵根两种构成的,所以NH5的电子式为 。
。
②Cu+易在酸性条件下发生反应2Cu+=Cu2++Cu,则CuH在过量稀盐酸中有气体生成的离子方程式为2CuH + 2H+ ==Cu +Cu2+ + 2H2 ↑。
③硝酸具有强氧化性,因此铜转化为硝酸铜,还原产物是NO,另外还有水和氢气生成,1molCuH失去2个电子,硝酸作氧化剂得到3个电子,则根据电子得失守恒和原子守恒可知配平后的方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O.
(4)溶液pH=6,则氢氧根离子的浓度水10—8mol/L,所以根据氢氧化铜的溶度积常数可知溶液中铜离子浓度是 =2.2×10-4mol/L。
=2.2×10-4mol/L。
考点:考查醛基的性质、电子式、氧化还原反应以及溶度积常数应用等


 考前必练系列答案
考前必练系列答案科目:高中化学 来源:2014-2015学年甘肃省高三上学期期末理综化学试卷(解析版) 题型:填空题
(16分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建立平衡, v(H2)=_____;该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
下列实验操作能达到目的的是
A.除去苯中混有的少量苯酚:加入适量NaOH溶液,振荡、静置后分液
B.除去乙酸乙酯中混有的少量乙酸:加入NaOH溶液并加热,振荡、静置后分液
C.检验卤代烃中的卤原子:取少量液体与NaOH溶液共热后滴加AgNO3溶液
D.检验FeCl3溶液中是否含有Fe2+:取少量溶液先滴加氯水,再滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:填空题
(14分)氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害。
Ⅰ.氨气是一种重要的化工原料。
(1)NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g) +2NH3(g) (NH2)2CO(s) +H2O(g) ,在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
(NH2)2CO(s) +H2O(g) ,在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:

则A点的逆反应速率V(逆)(CO2) B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 。
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s) 2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
Ⅱ.氮的氧化物会污染环境。
(3)采取还原法,用炭粉可将氮的氧化物还原。
已知:N2(g)+O2(g)=2NO(g) △H= +180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1
写出炭粉还原一氧化氮的热化学反应方程式 。
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为________。若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:选择题
某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不跟NaOH溶液反应的衍生物种类有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省部分高三1月份统一考试理综化学试卷(解析版) 题型:选择题
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共8分)
化合物E是一种化工产品,可以通过下图所示的路线合成:
已知: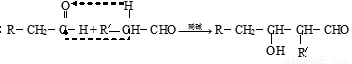
45.化合物II的结构简式为:
46.写出化合物III与新制氢氧化铜反应的化学方程式:
47.下列说法正确的是
A.化合物I遇氯化铁溶液能显色
B.化合物II能与NaHCO3溶液反应
C.1mol化合物III最多能与3mol H2反应
D.1mol化合物E完全燃烧消耗9.5mol O2
48.有机物R(C9H9ClO3)经过反应也可制得化合物E,则R在NaOH醇溶液中反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是

A.用装置甲氧化废液中的溴化氢 B.用装置以分离油层和水层
C.用装置甲分离四氯化碳和液溴 D.用仪器丁密封存放单质溴
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市上学期高三第四次月考理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、W、R的原子序数依次增大。 元素X是形成化合物种类最多的元素,Y、R同主族,R原子的最外层电子数是内层电子总数的一半, W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
A.X、W、R的最高价氧化物的水化物酸性强弱顺序是X<W<R
B.气态氢化物的稳定性:Y>R
C.X、Y、W、R的原子半径由大到小的顺序为R﹥ W﹥ X﹥Y
D.X、W的氧化物由固态转化为气态时,克服相同的作用力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com