
分析 依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答.
解答 解:Na2R为强电解质,完全电离1molNa2R电离生成2mol钠离子和1molR-,所以Na2R含Na+0.6mol,则Na2R物质的量为0.3mol,含R- 0.3 mol;$\frac{18.6g}{0.3mol}$=62g/mol;R-摩尔质量为:62-2×23=16(g/mol),R的相对原子质量为16;R的质量为1.6g的Na2R,含有R物质的量为:$\frac{1.6g}{16g/mol}$=0.1mol,则含R的质量为1.6g的Na2R,其物质的量为 0.1mol,含有钠离子的物质的量为0.2mol,Na+个数为用0.2NA;
故答案为:0.3; 62g/mol;16;0.1mol; 0.2NA.
点评 本题考查了阿伏伽德罗常数的有关计算和公式的运用,难度不大,掌握好以物质的量为核心的相关计算公式是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| t/% | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2s的平均速率v(CO)=0.080mol/L/s | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.11mol/L | |
| C. | T K时起始向容器中充入0.9molCOCl2/0.10molCO,反应达到平衡前v(正)>v(逆) | |
| D. | T K时起始向容器中充入1.0molCl2和0.9molCO.达到平衡时,Cl2的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 变化过程 | △H | △S |
| 4Fe(s)+3O2(g)=2Fe2O3(s) | <0 | |
| CaCO3(s)分解为CaO(s)和CO2(g) |
| 时间/min | A | B | C | D |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{27m}{v}$mol/L | B. | $\frac{m}{9v}$mol/L | C. | $\frac{m}{27v}$mol/L | D. | $\frac{m}{18v}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②①⑤ | B. | ④⑤③②① | C. | ④③①②⑤ | D. | ④②③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5g | |
| B. | 32g氧气中含有2mol氧 | |
| C. | 58.5gNaCl中含有l mol NaCl分子 | |
| D. | 0.l mol二氧化碳含有6.02×1022个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
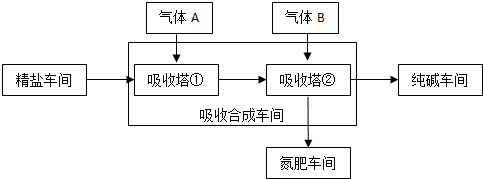
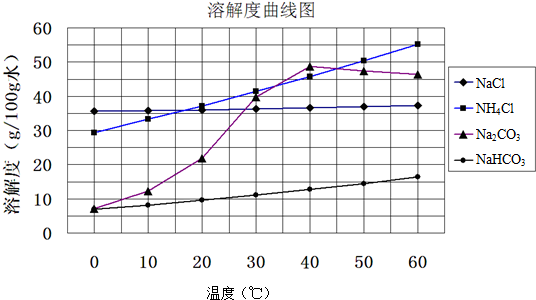
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com