
某化工厂以甲烷为主要原料来制取合成甲醇及合成氨的原料,其主要反应为:
CH4(g)+H2(g)![]() CO(g)+3H2(g)……①(反应中CH4转化率为1)
CO(g)+3H2(g)……①(反应中CH4转化率为1)
2CO4(g)+O2(g)![]() 2CO(g)+4H2(g)……②(反应中CH4转化率为1)
2CO(g)+4H2(g)……②(反应中CH4转化率为1)
CO(g)+2H2(g)![]() CH3OH(g)……(反应中CO转化率为2/3)
CH3OH(g)……(反应中CO转化率为2/3)
合成工艺如下:
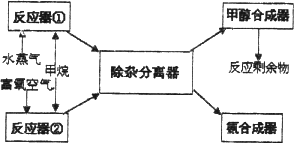
请回答下列问题(所有气体体积均折算为标准状况):
1.若只用反应器①来直接合成甲醇.当充入反应器①的甲烷和水蒸汽的体积分别为672 m3和2240 m3时,反应剩余物中CO为________mol、H2为________mol;
2.若CH4同时和H2O(g)及O2(g)反应,则am3CH4按上述两式完全反应,产物气体的体积V的范围为________.
3.若充入反应器①的甲烷和水蒸汽的体积分别为l体积和3体积,反应剩余物中:V(H2)∶V(N2)∶V(CO)=3∶1∶1.则充入反应器②的富氧空气(只含N2和H2)的体积为________;富氧空气中氧气体积分数为________.
4.若将25%的富氧空气、CH4和H2O(g)混合并充分反应,反应的产物中n(H2)/n(N2)=3∶1,来合成氨气,则反应中的H2O(g)和富氧空气的物质的量之比为________.
科目:高中化学 来源: 题型:
乙烯是石油化工的重要原料,它主要通过石油产品裂解获得。
(1)石油产品裂解所得裂解气的平均组成可表示为CnHm(m>2n),经测定某裂解气中各气体的体积分数分别为:甲烷―4%、乙烯―50%、丙烯―10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到50 mol乙烯,x mol丁二烯和y mol氢气。则x+y= , n / m = (请用含x的式子表示)。
(2)某化工厂每天由石油产品裂解得到乙烯56 t。再以乙烯为主要原料生产醋酸乙烯酯,醋酸乙烯酯是合成维尼纶的重要单体。生产原理如下:
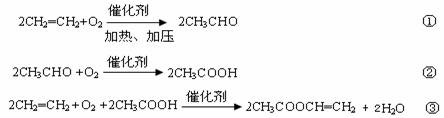
反应①中乙烯的利用率为80%,反应②中乙醛的利用率为83.33%,反应③中乙酸与乙烯的利用率均为85%。则该厂每天最多可制得醋酸乙烯酯多少吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。其制备及运用的一种工艺流程如图所示(其中X与X′的主要成分类似)。
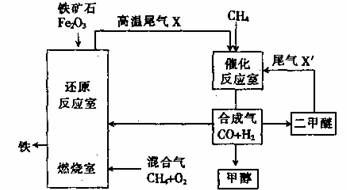
(1)在合成气冶炼金属铁的流程中,向燃烧室中通入甲烷与氧气的目的是 ,其最佳体积配比V(CH4):V(O2)为 。
(2)甲醇、二甲醚(CH3OCH3)等物质被称为21世纪的新型燃料,具有清洁、高效等优良的性能。
①写出用合成气生产甲醇的化学方程式: ,用该方法合成甲醇的最大优点是 。
②用合成气为原料生产二甲醚,随着原料配比的不同反应产物不尽相同,但产生的尾气可循环使用,试写出以CO、H2为原料制取二甲醚的两种不同的化学方程式: 、
。
(3)某化工厂试图使用上图所示流程联合生产甲醇、二甲醚、生铁,你认为是否可行?若不可行,请说明理由;若可行,联合生产有什么优点?
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com