
分析 (1)根据氯化镁的相对分子质量确定其摩尔质量;根据V=nVm计算出标准状况下0.1mol二氧化碳的体积;根据硝酸铜的化学式计算出硝酸根离子的浓度;
(2)物质导电的条件是存在自由电子或者自由移动的离子;水溶液中或熔融状态下能够导电的化合物称为电解质,包括酸、碱、盐都是电解质;
(3)醋酸为弱酸,在溶液中部分电离出醋酸根离子和氢离子.
解答 解:(1)MgCl2的相对分子质量为95,则其摩尔质量为:95g•mol-1;标准状况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L;
0.2mol•L-1的 Cu(NO3)2溶液中NO3-的物质的量浓度是:0.2mol/L×2=0.4mol/L,
故答案为:95g•mol-1;2.24 L;0.4 mol•L-1;
(2)能够导电,说明存在自由移动的带电粒子,满足条件的为:①熔融NaCl、③醋酸水溶液;
电解质是水溶液中或熔融状态下能够导电的化合物,满足条件的为:①熔融NaCl、④HCl气体,
故答案为:①③;①④;
(3)醋酸为弱电解质,在溶液中存在电离平衡,其电离方程式为:CH3COOH?CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+.
点评 本题考查了物质的量浓度计算、电解质与非电解质的判断、电离方程式书写等知识,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度的关系,明确电解质与非电解质的区别,能够正确书写电离方程式.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应 Na+H2O═OH-+H2↑ | |
| B. | NaHCO3溶液与盐酸的反应 CO32-+2H+═H2O+CO2↑ | |
| C. | 用FeCl3溶液腐蚀铜线路板 Cu+Fe3+═Cu2++Fe2+ | |
| D. | AlCl3溶液中加入过量氢氧化钠溶液 Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子式: 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 离子结构示意图: 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| C. | 比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 聚丙烯的结构简式: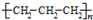 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象 | 解释 | |
| A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | SO2能使酸性高锰酸钾溶液褪色 | SO2具有还原性 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| D | 铁与稀硝酸反应有气泡产生 | 铁与稀硝酸发生了置换反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中含有的C-H键的数目为6NA | |
| B. | 0.lmol丙烯酸中含有的双键的数目为0.lNA | |
| C. | 1mol甲基(-CH3)中含有的电子总数为9NA | |
| D. | 标准状况下,22.4 L己烷完全燃烧生成的CO2分子的数目约为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素 | B. | 单质 | C. | 原子 | D. | 分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

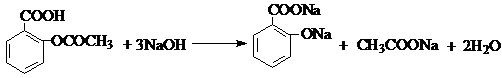 .
. ,请写出两步反应中依次
,请写出两步反应中依次查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 电解质 | Ka1 | Ka2 |
| H2S | 1.3×10-7 | 7.1×10-15 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com