
| A. | 加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体 | |
| B. | 除去MgCl2中的Fe3+,可以加入NaOH固体 | |
| C. | 明矾净水的反应:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| D. | 加热蒸干KCl溶液,最后得到KOH固体(不考虑CO2的反应) |
分析 A.Na2CO3水解生成的碳酸氢钠和NaOH,由于生成的氢氧化钠不具有挥发性,氢氧化钠与碳酸氢钠反应生成碳酸钠;
B.镁离子、铁离子均能与氢氧化钠反应;
C.铝离子水解生成的氢氧化铝胶体具有吸附性;
D.KCl在溶液中不水解.
解答 解:A.Na2CO3在溶液中水解生成碳酸氢钠和氢氧化钠,水解方程式为:Na2CO3+H2O?NaOH+NaHCO3,由于生成的NaOH不挥发,氢氧化钠能够与碳酸氢钠发生中和反应生成碳酸钠和水,所以将Na2CO3溶液加热蒸发后最终得到的固体仍然为Na2CO3,故A错误;
B.镁离子、铁离子均能与氢氧化钠反应,所以加NaOH不能除去MgCl2中的Fe3+,故B错误;
C.明矾在水中电离出铝离子,铝离子水解生成的氢氧化铝胶体具有吸附性,即Al3++3H2O?Al(OH)3(胶体)+3H+,故C正确;
D.KCl在溶液中不水解,加热蒸干KCl溶液,最后得到KCl固体,故D错误.
故选C.
点评 本题考查了盐的水解原理及其应用,题目难度不大,试题侧重基础知识的考查,注意掌握盐的水解原理及其应用方法,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
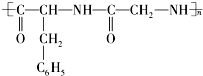 的单体是( )
的单体是( )| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
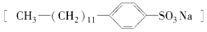 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
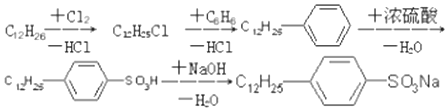
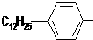 .
.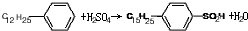 ,反应类型为取代反应.
,反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
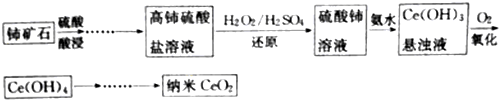
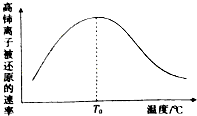
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
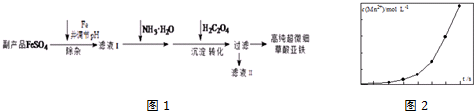
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
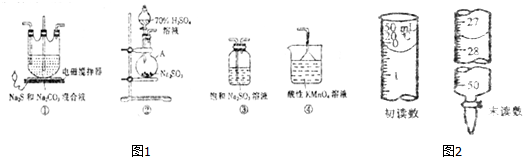

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com