
 [物质结构与性质]可以由下列反应合成三聚氰胺:
[物质结构与性质]可以由下列反应合成三聚氰胺: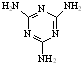 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(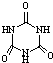 )后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键结合,在肾脏内易形成结石.
)后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键结合,在肾脏内易形成结石.分析 (1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理写出该原子的核外电子排布式;
(2)根据二氧化碳的空间构型确定CN22-离子的空间构型;
(3)根据价层电子对互斥理论确定尿素的VSEPR模型,根据模型确定其杂化方式和分子空间结构;
(4)氢键普遍存在于已经与N、O、F等电负性很大的原子形成共价键的氢原子与另外的N、O、F等电负性很大的原子之间;
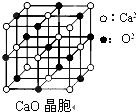
(5)CaO晶胞中与Ca2+离子最近且等距离的Ca2+离子数为3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算2次,所以与Ca2+离子最近且等距离的Ca2+离子数为(8×3)÷2=12个;晶格能大小与离子带电量成正比,与离子半径成反比.
解答 解:(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理,基态的锌原子核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;
(2)等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形,故答案为:直线形;
(3)CO(NH2)2分子中中心原子C原子上含有三个σ键一个π键,所以空间构型是平面三角形,碳原子采取sp2杂化,尿素分子的结构简式是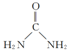 ,所以1mol 尿素分子[CO(NH2)2]中含有的σ键的数目7mol,故答案为:sp2;7mol;
,所以1mol 尿素分子[CO(NH2)2]中含有的σ键的数目7mol,故答案为:sp2;7mol;
(4)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石,故答案为:分子间氢键;
(5)CaO晶胞中与Ca2+离子最近且等距离的Ca2+离子数为3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算2次,所以与Ca2+离子最近且等距离的Ca2+离子数为(8×3)÷2=12个; 晶格能大小与离子带电量成正比,CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,
故答案为:12;CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量.
点评 本题考查了物质结构知识,涉及核外电子排布、分子空间构型、杂化原理、配合物的计算等,难度一般,易错点是配位数的确定,以一种微粒为中心,沿X、Y、Z三轴进行切割,从而确定配位数.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 可以用澄清石灰水鉴别SO2和CO2 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| C. | SO2能使溴水、酸性KMnO4溶液褪色 | |
| D. | 少量SO2通过浓的氯化钙溶液能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.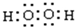 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为X<Y<Z<W | |
| B. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物更加稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
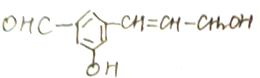 在下列反应中生成的有机物的结构简式.
在下列反应中生成的有机物的结构简式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 0.1 mol/L | C. | 0.01 mol/L | D. | 10 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有气体产生 | B. | 生成白色沉淀 | ||
| C. | 生成无色透明溶液 | D. | 产生气体和白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com