
����Ŀ��һ���¶��£�����K2S����Cu2+��Mn2+��Zn2+��������(M2+)������S2�����Ũ�ȵĶ���ֵlgc(S2��)��lgc(M2+)�Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��

A.�������Ӷ�Ӧ��������ܶȻ������У�Ksp(MnS)���ԼΪ1��10-15��Ksp(CuS)��С��ԼΪ1��10-35
B.MnS+Cu2+![]() CuS+Mn2+��K=1020
CuS+Mn2+��K=1020
C.��ZnS������Һ(��ZnS����)�еμ�����ˮ�������ܽ�ƽ�����ܽ�ķ����ƶ���c(S2��)����
D.��Cu2+��Zn2+��Mn2+�����Һ����μ���1��10��4mol��L��1��Na2S��Һ��Cu2+���ȳ���
���𰸡�D
��������
A. ����MS�������ܶȻ�Ksp=c(M2+)c(S2-)������ͬʱ��������ݴ˷�����
B. Ksp(MnS)> Ksp(ZnS)> Ksp(CuS)���ݴ��жϣ�
C.��ZnS������Һ�еμ�����ˮ�������������ܽ�ƽ�⣻
D. Ksp(MnS)> Ksp(ZnS)> Ksp(CuS)���ܽ��ԽСԽ�����γɡ�
A. ����MS�������ܶȻ�Ksp=c(M2+)c(S2-)������ͬʱ���������lgc(M2+)=-lgc(S2-)+lgKsp��MnS��lgKsp = lgc(M2+)+lgc(S2-)=-15��Ksp=1��10-15��ZnS��lgKsp = lgc(M2+)+lgc(S2-)=-23���ң�Ksp=1��10-23���ң�CuS��lgKsp = lgc(M2+)+lgc(S2-)=-35��Ksp=1��10-35�����������ݿ�֪�������Ӷ�Ӧ��������ܶȻ������У�Ksp(MnS)���ԼΪ1��10-15��Ksp(CuS)��С��ԼΪ1��10-35��A����ȷ��
B. Ksp(MnS)> Ksp(CuS)����˷�ӦMnS+Cu2+![]() CuS+Mn2+���Է�����K=
CuS+Mn2+���Է�����K= =
=![]() =1020��B����ȷ��
=1020��B����ȷ��
C. ��ZnS������Һ�еμ�����ˮ���Կɽ��������ܽ�ƽ�⣬��Һ���ܴﵽ���ͣ�������Һ��c(S2-)�ǹ̶��ģ�C����ȷ��
D. Ksp(MnS)> Ksp(ZnS)> Ksp(CuS)���ܽ��ԽСԽ�����γɣ���Cu2+��Zn2+��Mn2+�����Һ��Ũ��δ֪����μ���1��10��4mol��L��1��Na2S��Һ˭���ȳ�������ȷ����D�����
��ѡD��


 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.̼�ظ��ں�ˮ�з����ĸ�ʴ��Ҫ�����ⸯʴ
B.������Ʒ�����пʱ������Ʒ���Դ��������
C.NaHCO3��Һ��ˮ�ⷽ��ʽΪ��HCO![]() +H2O
+H2O![]() CO
CO![]() +H3O+
+H3O+
D.��֪����ʱKsp[Mg(OH)2]=5.6��10-12��������pH=8��Mg(OH)2����Һ��c(Mg2+)=5.6mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��IJ����������ԭ������ȷ����
�����˲����ɼӿ�����ٶȣ���������ϣ���Ӧ�ȹر�ˮ��ͷ��Ȼ��������ӳ����ú�����ƿ����Ƥ�ܣ����������ҵĽ���Һ�м����������ˮ���Ա�֤I����ȫ����ΪI2�����ؽᾧʱ����Һ��ȴ�ٶ�Խ���õ��ľ������Խ��������ˮ�������顢���Ȼ�̼���Ҵ�������ɫҺ�壻����֬��������������ķ���ʹ��֬�����ƺ��ͳ�ַ��룻����øϴ�·ۿ�����ϴ����֯Ʒ������֯Ʒ�͵���֯Ʒ������������茶����Ʊ�ʵ������һ���ǽ���Һ�������д����������������������ɼ��ɵò������ȡʱ�IJ�����ͼ
![]()
A.�ڢܢ�B.�٢ۢ�C.�ۢܢ�D.�ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Ũ��Ϊ0.01mol��L-1��HA��Һ�ζ�20mLŨ��Ϊ0.01mol��L-1��NaOH��Һ���ζ�������ͼ��ʾ������˵���������ǣ� ��
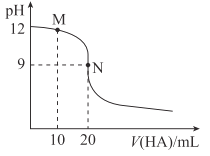
A. Ӧѡ�÷�̪��ָʾ��
B. M����Һ�д��ڣ�c��Na+��>c��A-��
C. Ka��HA����2��10-8
D. N����Һ�д��ڣ�c��OH-��-c��H+��=c��HA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƽ����������ԭ��Ӧ����ʽ��
(1)______![]() ______HCl��______
______HCl��______![]() ______
______![]() ______
______![]() ______
______![]()
(2)______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______H2O
______H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ӷ���ʽ��д��ȷ����![]()
A.![]() ��Һ������������������Һ��ϼ��ȣ�
��Һ������������������Һ��ϼ��ȣ�![]()
B.��![]() ��Һ�м�������ij���ʯ��ˮ��
��Һ�м�������ij���ʯ��ˮ��![]()
C.�����ʵ�����![]() ��
��![]() ����Һ�еķ�Ӧ��
����Һ�еķ�Ӧ��![]()
D.��84����Һ�������������![]() ��Ҫ�ɷ�Ϊ����
��Ҫ�ɷ�Ϊ����![]() ���ʹ�û�����ж����壺
���ʹ�û�����ж����壺![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ء���Ԫ�ء�ͭԪ���ڻ�ѧս�к���Ҫ�ĵ�λ�����ʼ��仯�����ڹ�ũҵ�������������й㷺��Ӧ�ã�
(1)��֪CaC2��ˮ��Ӧ������Ȳ����ش��������⣺
�ٽ���Ȳͨ�� [Cu(NH3)2]Cl��Һ������Cu2C2����ɫ������ Cu+��̬��������Ų�ʽΪ ______ ��
��CaC2��![]() ��
��![]() ��Ϊ�ȵ����壮 1mol
��Ϊ�ȵ����壮 1mol![]() �к��е�������ĿΪ ______ ��
�к��е�������ĿΪ ______ ��
����Ȳ�������ᷴӦ�ɵñ�ϩ��(CH2=CHC=N)����ϩ�������̼ԭ�ӹ���ӻ���
���� ______ �����ɱ�ϩ��Ԫ���е�һ������������ ______��
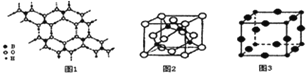
(2)���� (H3BO3)��һ��Ƭ��״�ṹ�İ�ɫ���壬���ڵ�H3BO3���Ӽ�ͨ���⽡����(����ͼ1)����1mol H3BO3�ľ������� ______ mol�������������ˮ�����������һˮ������B(OH)3��H2O����������������[B(OH)4]-��H+����[B(OH)4]-�Ŀռ乹��Ϊ ______
(3)ijMԭ�ӵ���Χ�����Ų�ʽΪ3s23p5��ͭ��M�γɻ�����ľ�������ͼ2��ʾ![]() �ڵ����ͭԭ�ӣ�����Բ����Mԭ��
�ڵ����ͭԭ�ӣ�����Բ����Mԭ��![]() ��
��
![]() �þ��廯ѧʽΪ ______ ��
�þ��廯ѧʽΪ ______ ��
![]() ��֪ͭ��M�ĵ縺�Էֱ�Ϊ1.9��3.0����ͭ��M�γɵĻ��������� ______
��֪ͭ��M�ĵ縺�Էֱ�Ϊ1.9��3.0����ͭ��M�γɵĻ��������� ______ ![]() ��������������������
��������������������![]() �����
�����
(4)Cu3N�ľ����ṹ������ͼ3�� N3-����λ��Ϊ ______ ��Cu+�뾶Ϊapm��N3-�뾶Ϊbpm��Cu3N���ܶ�Ϊ ______ g��cm-3��(�����ӵ�������![]() ��ʾ)
��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҽ�ˮ�����㹻ǿ�ĵ糡�У��� 20��ʱˮ����˲�����̿��γ���ů������ij��ȤС������ͼ��ʾʵ�飬�����ձ������� KMnO4 ��Һ��ɫ���������ݲ����������� KMnO4 ��Һ����FeCl3 ��Һ���ձ�����Һ��ɫ�ޱ仯���������ݲ�����������˵������ȷ����
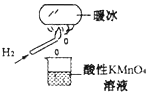
A. 20 ��ʱ��ˮ�����γɵ���ů�����������ı仯�ǻ�ѧ�仯
B. ��ů������ˮ�����㹻ǿ�ĵ糡���γɵĻ����
C. �ձ���Һ��ΪFeCl3 ��Һʱ������������ΪCl2
D. ��������H2 ȼ�յIJ����п��ܺ���һ������H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�棨CH2=CHCN����һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ�������ϩ������������������Ҫ�������б�ϩȩ��CH2=CHCHO�������棨CH3CN���ȣ��ش��������⣺
��1���Ա�ϩ����������Ϊԭ�ϣ��ڴ������������ɱ�ϩ�棨C3H3N���������ϩȩ��C3H4O�����Ȼ�ѧ����ʽ���£�
��C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ��H=-515kJ/mol
��C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ��H=-353kJ/mol
������Ӧ������ѧ�����ƾ��ܴ���ԭ����________����������߱�ϩ��ƽ����ʵķ�Ӧ������________����߱�ϩ�淴Ӧѡ���ԵĹؼ�������________��
��2��ͼ��a��Ϊ��ϩ������뷴Ӧ�¶ȵĹ�ϵ���ߣ���߲��ʶ�Ӧ�¶�Ϊ460��������460��ʱ����ϩ��IJ���________��������������������������Ӧ�¶��µ�ƽ����ʣ��ж�������________������460��ʱ����ϩ����ʽ��͵Ŀ���ԭ����________��˫ѡ�����ţ�
A���������Խ��� | B��ƽ�ⳣ����� | C������Ӧ���� | D����Ӧ������� |

��3����ϩ��ͱ�ϩȩ�IJ�����n������/n����ϩ���Ĺ�ϵ��ͼ��b����ʾ����ͼ��֪�����n������/n����ϩ��ԼΪ��������_______________�����ϰ�����������ϩ���������ԼΪ________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com