
(1)现用物质的量浓度为amol/L的标准盐酸去测定VmLNaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
②下图是酸式滴定管中液面在滴定前后的读数,则被测NaOH溶液的的物质的量浓度为:c(NaOH)= ________________。
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测得的NaOH溶液的物质的量浓度会偏_________________。
(2)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。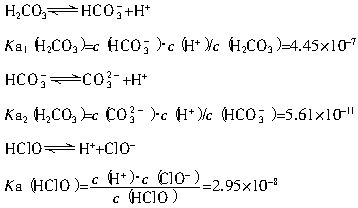
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将过量的氯气通入到少量的碳酸钠溶液中______________________________________;
②氯气和碳酸钠按照1∶1的比例恰好反应_____________________________________。
(3)铬是1979年法国化学家沃克兰在分析铬铅矿时首先发现的。铬位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中+3较为稳定。某兴趣小组对铬的化合物进行探究性研究发现:Cr2O3微溶于水,与A12O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡。Cr(OH)3酸式电离的电离方程式是:_________。
科目:高中化学 来源: 题型:
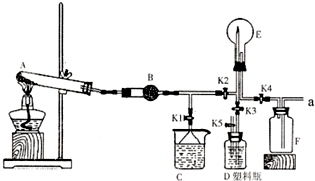 如图是实验室中某种气体的制备、性质检验及收集装置图.
如图是实验室中某种气体的制备、性质检验及收集装置图.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 高温 |
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试 管中滴入几滴KSCN溶液. |
|
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
Ⅰ | 7.4 | 40.00 | 1.68 |
Ⅱ | 14.8 | 40.00 | 3.36 |
Ⅲ | 22.2 | 40.00 | 1.12 |
Ⅳ | 37.0 | 40.00 | 0.00 |
(1)写出实验过程中有关的离子方程式。
(2)由表格数据直接推测标准状况下3.7 g样品进行同样实验时,生成氨气的体积为多少升?
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓,度应选择第_________组数据,由此求得NaOH溶液的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0.00 |
(1)写出实验过程中有关的离子方程式。
(2)由表格数据直接推测标准状况下3.7 g样品进行同样实验时,生成氨气的体积为多少升?
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓,度应选择第_________组数据,由此求得NaOH溶液的物质的量浓度为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com