
下列叙述正确的是
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列各组离子中,在溶液中能大量共存,加入氢氧化钠溶液有沉淀析出,加入稀盐酸有气体放出的是
A.Na+、Ca2+、SO42―、CO32― B.K+、Ba2+、HCO3―、Cl―
C.K+、Al3+、SO42―、NO3― D.K+、Na+、CO32―、SO42―
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期半期考试化学试卷(解析版) 题型:实验题
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体还原Fe3+生成的还原产物是 (填离子符号),参加反应的SO2 和Fe3+的物质的量之比是 。
(2)下列实验方案适用于在实验室制取所需SO2的是 (双选,填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是 。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有 (双选,填序号)。
A 蒸发皿 B 石棉网 C 漏斗 D 烧杯 E 玻璃棒 F 坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的一个是 ,原因是 。
(6)上述装置中能表明I-的还原性弱于SO2的现象是 。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上半期考试理综化学试卷(解析版) 题型:选择题
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计),则下列说法错误的是
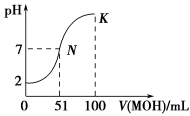
A.常温下,MA的水溶液的pH=a,由水电离产生的c(H+)=1×10-a mol·L-1
B.在K点,水溶液中存在:c(M+) = 2c(A-)
C.在N点,水溶液中存在:c(M+) + c(H+)= c(A-)+ c(OH-)
D.在K点,若此时溶液的pH=10,则c(MOH)+c(M+)=0.01mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:填空题
I. (1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择 (填序号)。
①1mL 0.01 mol·L—1的碘水 ②1mL 0.001 mol·L—1的碘水
③4mL 0.01 mol·L—1的Na2S2O3溶液 ④4mL 0.001 mol·L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32—)=
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) 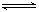 CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为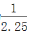 ,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
0min | 5min | 10min | |
CO | 0.01 | 0.0056 | |
H2O | 0.01 | 0.0156 | |
CO2 | 0 | 0.0044 | |
H2 | 0 | 0.0044 |
(1)请计算5min时H2O的平衡浓度__________。
(2)CO的平衡转化率为____________。
(3)若5min~10min只改变了某一条件,该条件是__________,如何改变的___________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:选择题
下列离子方程式 错误的是
A.向Ba(OH)2溶液中滴加稀硫酸: Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2: 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
C.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:
NH4++Al3++SO42-+Ba2++4OH-= BaSO4↓+Al (OH)3↓+NH3·H2O
D.铅蓄电池充电时的正极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42-
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:选择题
已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。现以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
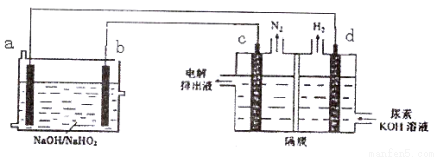
A.燃料电池的总反应为:2Al+3HO2- = 2AlO2- + 2H2O
B.电解时,Al消耗2.7g,则产生氮气的体积为1.12L
C.电极b是负极,且反应后该电极区pH增大
D.电解过程中,电子的流向由a→d,c→b。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第二次诊断测试化学试卷(解析版) 题型:实验题
实验室用下列装置所示的流程进行气体性质实验。图中用箭头表示气体的流向,A为一种纯净、干燥的气体,B是另一种气体,己中有红棕色气体出现。实验中所用的药品只能从下列物质中选取:Na2CO3、NaHCO3、Na2O、Na2O2、NaCl、无水CaCl2、(NH4)2CO3、碱石灰等固体和蒸馏水。根据图中装置和现象请回答:
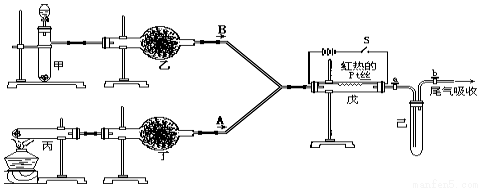
(1)按上图组装好实验装置后,首先进行的操作是 。
(2)丙中发生反应的化学方程式为 。
(3)丁中应选用的干燥剂 ,戊中的反应开始后断开电源,铂丝继续保持红热,说明该反应 (填“吸热”或“放热”)。
(4)戊中发生的主要反应的化学方程式
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州遵义航天中学高二上第三次月考化学卷(解析版) 题型:?????
下列对溶液叙述正确的是( )
A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小
B.对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的PH相等,则m<n
C.在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用
D.25 ℃时NH4Cl溶液的Kw大于100 ℃时NaCl溶液的Kw
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com