
分析 n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,
(1)该反应中Mn元素化合价由+4价变为+2价,Cl元素化合价由-1价变为0价,转移电子数为2;
(2)根据方程式知,1mol二氧化锰参加反应需要4molHCl,则0.2mol二氧化锰参加反应需要n(HCl)=4n(MnO2)=4×0.2mol=0.8mol,根据m=nM计算参加反应的HCl的质量;
(3)根据方程式知,参加反应的HCl有一半的被氧化,据此计算被氧化的HCl的物质的量.
解答 解:n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,
(1)该反应中Mn元素化合价由+4价变为+2价,Cl元素化合价由-1价变为0价,转移电子数为2,用双线桥表示电子转移方向和数目为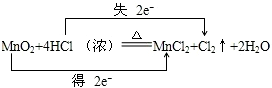 ,
,
答:电子转移方向和数目为 ;
;
(2)根据方程式知,1mol二氧化锰参加反应需要4molHCl,则0.2mol二氧化锰参加反应需要n(HCl)=4n(MnO2)=4×0.2mol=0.8mol,m(HCl)=nM=0.8mol×36.5g/mol=29.2g,
答:参加反应的氯化氢有29.2g;
(3)根据方程式知,参加反应的HCl有一半的被氧化,则被氧化的HCl的物质的量=$\frac{1}{2}$×0.8mol=0.4mol,
答:被氧化的氯化氢的物质的量是0.4mol.
点评 本题考查氧化还原反应有关计算,为高频考点,熟悉方程式中各个物理量之间关系是解本题关键,注意该反应中浓盐酸的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 防止氯气通过漏斗扩散到空气中造成污染 | |
| B. | 便于控制加入浓盐酸的量 | |
| C. | 因长颈漏斗加热时容易破裂 | |
| D. | 尽量避免HC1挥发到空气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫是非电解质 | |
| B. | 氢离子浓度相同的盐酸和醋酸导电能力相同 | |
| C. | 庆阳化铁胶体能导电,故氢氧化铁胶体是电解质 | |
| D. | 在相同温度下,饱和溶液不一定比不饱和溶液的导电性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH(OH)COOH | B. |  | ||
| C. | CH3CH2COOH | D. | HOOC-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加酚酞呈红色的溶液:I-,ClO-,NO3-,Na+ | |
| B. | 含有Fe3+的溶液:K+,Mg2+,SCN-,HSO3- | |
| C. | $\frac{Kw}{c({H}^{+})}$=0.1mol•L-1的溶液:Na+,K+,SiO32-,Br- | |
| D. | 加Al能生成H2的溶液:Na+,K+,CO32-,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{2}$mol | B. | $\frac{b}{2}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气溶于水,须通入倒置并边缘没入水中的漏斗 | |
| B. | 粉碎结块的硝酸铵,可将药品放入研体中轻轻敲碎 | |
| C. | 洗涤做过银镜反应的试管,先用浓硝酸洗涤,再用自来水冲洗 | |
| D. | 玻璃导管与橡皮导管连接,可使玻璃导管蘸水后边旋转边插入橡皮导管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t1~t2 | t3~t4 | t4~t5 | t6~t7 |
| K1 | K2 | K3 | K4 |

| 物质 | CO2 | CH4 | CO | H2 |
| 浓度(mol•L-1) | 1 | 1 | 1 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com