
短周期元素X、Y、Z、W原子序数依次增大。X的质子数与电子层数相同,Y、Z同周期且相邻,Z的最外层电子数是其内层电子数的3倍,元素W在地壳中的含量仅次于氧。下列说法正确的是
A.原子半径:r(W)>r(Y)>r(Z)>r(X)
B.X、Y、Z三种元素形成的化合物中只有共价键
C.最高价氧化物对应水化物的酸性:W>Y
D.气态简单氢化物的热稳定性:Y>Z
科目:高中化学 来源: 题型:
由CH3CH=CH2合成CH2(OOCCH3)CH(OOCCH3)CH2(OOCCH3)时,需要经过的反应( )
A. 加成→取代→取代→取代 B. 取代→加成→取代→取代
C. 取代→取代→加成→取代 D. 取代→取代→取代→加成
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是一个电解装置图,某实验兴趣小组做完实验后,在读书卡片上写下了一些记录:()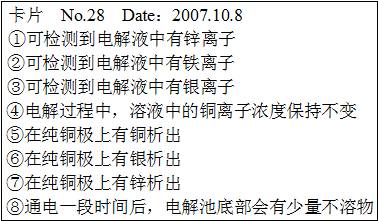 卡片上描述合理的是(已知粗铜中除含有铜以外,还含有少量锌、铁、银)
卡片上描述合理的是(已知粗铜中除含有铜以外,还含有少量锌、铁、银)
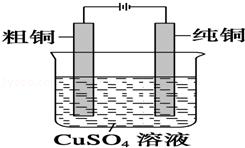
A. ①②⑤⑧ B. ①⑤⑧ C. ①②④⑤⑧ D. ③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
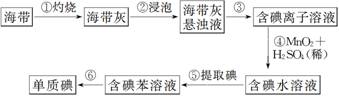 下图为实验室从海带中提取碘单质的流程示意图,判断下列说法错误的是
下图为实验室从海带中提取碘单质的流程示意图,判断下列说法错误的是
A. 步骤①需要用到蒸发皿 B. 步骤③需要过滤装置
C. 步骤⑤需要用到分液漏斗 D. 步骤⑥需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录。
| 步 骤 | 现 象 |
| I. 取5 mL 0.1 mol/L AgNO3与一定体积0.1 mol/L NaCl溶液,混合,振荡。 | 立即产生白色沉淀 |
| II. 向所得悬浊液中加入2.5 mL 0.1 mol/L Na2S溶液。 | 沉淀迅速变为黑色 |
| III. 将上述黑色浊液,放置在空气中,不断搅拌。 | 较长时间后,沉淀变为乳白色 |
| IV. 滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液。 | 产生红棕色气体,沉淀部分溶解 |
| V. 过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液。 | 产生白色沉淀 |
(1) 为了证明沉淀变黑是AgCl转化为Ag2S的缘故,步骤I中NaCl溶液的体积范围为 。
(2) 已知:25℃时Ksp(AgCl)=1.8×10-10 ,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K= 。
(3)步骤V中产生的白色沉淀的化学式为 ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 。
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
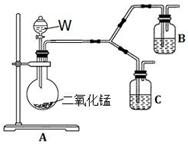
①装置A中玻璃仪器有圆底烧瓶、导管和 ,试剂W为 。
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为 。
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:
□Ag2S + □NaCl + □ + □  □AgCl + □ S + □
□AgCl + □ S + □
B中NaCl的作用是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体。已知:
2CO(g)+O2(g)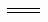 2CO2(g) ΔH=akJ·mol-1
2CO2(g) ΔH=akJ·mol-1
N2(g)+O2(g)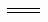 2NO(g) ΔH=b kJ·mol-1
2NO(g) ΔH=b kJ·mol-1
①反应2NO(g)+ 2CO(g)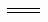 2CO2(g) +N2(g) ΔH=_________kJ·mol-1。
2CO2(g) +N2(g) ΔH=_________kJ·mol-1。
②可以利用反应:NO2+G N2+H2O+nX(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
N2+H2O+nX(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
当反应中转移1.2mol电子时,消耗NO2__________L(标准状况)。
③用NaOH溶液吸收工业尾气中的SO2最终制得石膏(CaSO4.2H2O)。为节约资源减少排放实现物质的循环利用,生产过程中还需要加入的固体物质是____________(填化学式)。
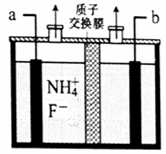
(2)工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示。则a极为___________极,该极的电极反应式_______________________________________。
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于________________法。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com