
分析 (1)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)参加反应的c(SO2)=0.4mol/L×80%=0.32mol/L,
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L)0.4 0.96 0
反应(mol/L)0.32 0.16 0.32
平衡(mol/L)0.08 0.8 0.32
根据化学平衡常数公式计算该温度下的化学平衡常数K.
解答 解:(1)该反应化学平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$,
答:该反应化学平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$;
(2)参加反应的c(SO2)=0.4mol/L×80%=0.32mol/L,
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L)0.4 0.96 0
反应(mol/L)0.32 0.16 0.32
平衡(mol/L)0.08 0.8 0.32
该反应化学平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$=$\frac{0.3{2}^{2}}{0.0{8}^{2}×0.8}$=20,
答:该温度下化学平衡常数K=20.
点评 本题考查化学平衡有关计算,为高频考点,明确化学平衡常数公式含义是解本题关键,注意计算时要用平衡时各物质浓度而不是物质的量.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+ 不与I-发生反应 | |
| B. | F-使I-的还原性减弱 | |
| C. | Fe3+ 与F-结合成不与I-反应的物质 | |
| D. | Fe3+ 被F-还原为Fe2+使溶液中不再存在Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-) | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)前者小于后者 | |
| D. | Na2CO3溶液加入少量Ca(OH)2固体,CO32-水解成都减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
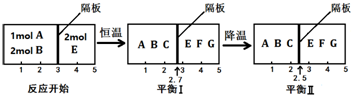
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.4 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
| n(H2)(mol) | 1.2 | 1.05 | n1 | n2 | n2 | n2 |
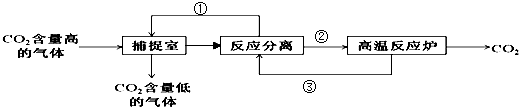
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发利用太阳能 | B. | 提倡垃圾分类处理 | ||
| C. | 改进汽车尾气净化技术 | D. | 将工业废水直接排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com