
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中 减小
减小
C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 • H2O的电离常数Kb=
D
【解析】
试题分析:A、向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,这说明平衡I3- I2+I-加入适量CCl4后,有利于平衡I3-
I2+I-加入适量CCl4后,有利于平衡I3- I2+I-向右移动,I2溶解在CCl4中显紫红色,A不正确;B、醋酸是弱酸,存在电离平衡,稀释促进电离。由于
I2+I-向右移动,I2溶解在CCl4中显紫红色,A不正确;B、醋酸是弱酸,存在电离平衡,稀释促进电离。由于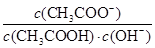 =
= =
= ,因为温度不变,所以
,因为温度不变,所以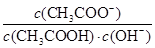 不变,B不正确;C、根据HF的电离常数大于醋酸的电离常数,所以醋酸钾的水解程度大于NaF的水解程度,即醋酸钾溶液的碱性强于NaF溶液的碱性。根据电荷守恒可知c(Na+)+c1(H+)=c(F-)+c1(OH-)、c(K+)+c2(H+)=c(CH3COO-) +c2(OH-),则c(Na+) -c(F-)=c1(OH-) -c1(H+)、c(K+)-c(CH3COO-)=c2(OH-) -c2(H+)。因为c1(OH-)<c2(OH-),c1(H+)>c2(H+),所以c(Na+) -c(F-)<c(K+)-c(CH3COO-),C不正确;D、在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+) =c(Cl-)=0.01 mol/L÷2=0.005mol/L。根据电荷守恒可知c(NH4+)
+c(H+)=c(Cl-)+c(OH-),因此c(H+)=c(OH-)=10-7mol/L,而溶液中c(NH3·H2O)=(0.5a-0.005)mol/L,则根据氨水的电离常数表达式可知Kb=
不变,B不正确;C、根据HF的电离常数大于醋酸的电离常数,所以醋酸钾的水解程度大于NaF的水解程度,即醋酸钾溶液的碱性强于NaF溶液的碱性。根据电荷守恒可知c(Na+)+c1(H+)=c(F-)+c1(OH-)、c(K+)+c2(H+)=c(CH3COO-) +c2(OH-),则c(Na+) -c(F-)=c1(OH-) -c1(H+)、c(K+)-c(CH3COO-)=c2(OH-) -c2(H+)。因为c1(OH-)<c2(OH-),c1(H+)>c2(H+),所以c(Na+) -c(F-)<c(K+)-c(CH3COO-),C不正确;D、在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+) =c(Cl-)=0.01 mol/L÷2=0.005mol/L。根据电荷守恒可知c(NH4+)
+c(H+)=c(Cl-)+c(OH-),因此c(H+)=c(OH-)=10-7mol/L,而溶液中c(NH3·H2O)=(0.5a-0.005)mol/L,则根据氨水的电离常数表达式可知Kb= =
= =
= ,D正确。
,D正确。
考点:考查外界条件对平衡状态和电离平衡的影响;盐类水解和溶液中离子浓度大小比较;电离平衡常数的计算等


科目:高中化学 来源: 题型:
 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH| SOCl2 |





 (任写2种)
(任写2种) (任写2种)
(任写2种)

查看答案和解析>>
科目:高中化学 来源: 题型:

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.

| ||
| ||


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com