
���� ��1�����ݷ�Ӧ�ȼ���μӷ�Ӧ�Ķ�����������ʵ�������������ʽ������ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻��Ϊ����Ӧ�Ƿ��ȷ�Ӧ�����������¶�K����С��
��2������ƽ���ƶ��ķ����жϣ�
��3��A������ֻ�ı仯ѧ��Ӧ���ʲ�Ӱ�컯ѧƽ�⣻
B���ӻ�ѧ��Ӧ�����������Ǽ�ѹǿ�ϸߣ�����ѹǿƽ�����ƣ�B��ת��������
C���ӻ�ѧ��Ӧ�����������Ǽ��¶Ƚϸߣ������¶�ƽ�����ƶ���B��ת���ʼ�С��
D��������Ӱ�컯ѧƽ�⣬ƽ��ʱѹǿ���䣬����Ч��Խ�ߣ�����ƽ���ʱ��Խ�̣�
��4��ԭ��ظ�������������Ӧ��SO2����������SO42-��
��5�����ø�˹���ɣ����Ȼ�ѧ����ʽ�������㣻
��6����̼�ᱵ�����ᱵ���ֳ�������ʱ����Һ�б�����Ũ��Ϊ��ֵ�������ܶȻ����㣮
��� �⣺��1����ʼʱ��10L���ܱ������м���4.0mol SO2��g����10.0mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�197kJ��������������SO2Ϊ2mol��
2SO2��g��+O2��g��?2SO3��g����
��ʼ��4mol 10mol 0
ת����2mol 1mol 2mol
ƽ�⣺2mol 9mol 2mol
����K=$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}•[{O}_{2}]}$=$\frac{0��{2}^{2}}{0��{2}^{2}��0.9}$=$\frac{10}{9}$����Ϊ����Ӧ�Ƿ��ȷ�Ӧ�����������¶�K����С��
�ʴ�Ϊ��$\frac{10}{9}$����С��
��2��A�������¶Ⱥ�����������䣬����2mol SO3��ƽ�����淴Ӧ�����ƶ�����SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ������A��ȷ��
B�������¶Ⱥ�����������䣬����2mol N2����ƽ���ƶ�û��Ӱ�죬�����ʵ�Ũ�Ȳ��䣬��B����
C�������¶Ⱥ�������ѹǿ���䣬����1mol SO3�����ڵ�Чƽ��״̬��Ũ�Ȳ��䣬��C����
D�������¶ȣ�ƽ�����淴Ӧ�����ƶ���SO3��Ũ�ȼ�С����D����
�ʴ�Ϊ��A��
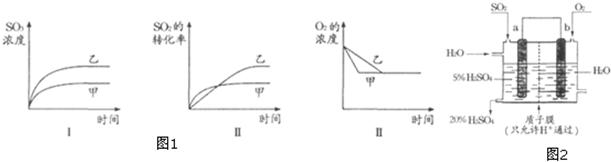
��3��A��ͼI�У����ݵ���ƽ��ʱ���֪�����������µĻ�ѧ��Ӧ���ʣ����Ա��ڼ������µĻ�ѧ��Ӧ���ʿ죻����������C��ƽ��Ũ�ȣ����ڼ������µ�C��ƽ��Ũ�ȴ���Ƚ϶��ԣ������Ҽ������ڴ˷�Ӧ�Ļ�ѧ��Ӧ����������������ƽ��������Ӧ�����ƶ���˵���ס���������������Ӱ�컯ѧ��Ӧ���ʣ�����Ӱ�컯ѧƽ�⣬��������Ӱ�컯ѧƽ�⣬��A����
B���ӻ�ѧ��Ӧ�����������Ǽ�ѹǿ�ϸߣ�����ѹǿƽ�����ƣ�B��ת����������ͼ������B����
C��ͼ����ݵ���ƽ��ʱ���֪������ס��������������¶ȶԷ�Ӧ��Ӱ�죬�ӻ�ѧ��Ӧ�����������Ǽ��¶Ƚϸߣ������¶�ƽ�����淴Ӧ�ƶ����ʼ�ת����С���ҵ�ת���ʣ�ͼ����ʵ������ϣ���C��ȷ��
D������ֻ�ı仯ѧ��Ӧ���ʲ�Ӱ�컯ѧƽ�⣬����ʱ��̣���Ӧ���ʿ죬��Ĵ�Ч�ʸߣ���D��ȷ��
��ѡ��CD��
��4��ԭ��ظ�������������Ӧ��SO2����������SO42-�������缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
��5��2SO2��g��+O2��g��2SO3��g����H1=һ197kJ/mol ��
H2O ��g��=H2O��1����H2=һ44kJ/mol ��
2SO2��g��+O2��g��+2H2O��g��=2H2SO4��l����H3=һ545kJ/mol��
���ø�˹���ɣ�����-��-�ڡ�2����2 ��SO3 ��g��+H2O��l��=H2SO4��l����H=-130kJ/mol��
�ʴ�Ϊ��SO3 ��g��+H2O��l��=H2SO4��l����H=-130kJ/mol��
��6��Ksp��Ba SO4��=c��Ba2+����SO42-��=1.3��10-10��Ksp��BaCO3��=c��Ba2+��c��CO32-��=2.6��10-9��
����c��CO32-����c��SO42-��=Ksp��BaCO3����Ksp��Ba SO4��=5.2��10-9��1.3��10-10=40��1��
�ʴ�Ϊ��1��40��
���� ���⿼���Ϊ�ۺϣ��漰��ѧƽ��͵绯ѧ֪ʶ����ѧƽ��ͼ���⣬����ʱע����������Ի�ѧƽ���Ӱ�죬��ȷ����ͼ�������ߵı仯�ص��DZ���Ľ��ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ${\;}_{15}^{30}P$��${\;}_{14}^{30}Si$+x | B�� | ${\;}_{7}^{14}N{+}_{0}^{1}n$��${\;}_{6}^{14}C$+x | ||
| C�� | ${\;}_{27}^{60}Co$��${\;}_{28}^{60}Ni$+x | D�� | ${\;}_{13}^{27}Al{+}_{2}^{4}He$��${\;}_{15}^{30}P$+x |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2�� | B�� | 3�� | C�� | 4�� | D�� | 5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ���������ˮ�ԣ������ʹ����̼�� | |
| B�� | ��SO2ͨ��Ʒ����Һ����Һ��ɫ����Ȼָ�ԭɫ����SO2ͨ����ˮ����ˮ��ɫ�����Ҳ�ָܻ�ԭɫ | |
| C�� | �ڷ�ӦSO2+2H2S�T3S+2H2O��SO2�������� | |
| D�� | ����ڹ����Ĵ�����ȼ�տ�������SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | IA�壬���ʵ��۵����� | |
| B�� | ��A�壬����̬�⻯�ﻹԭ������ǿ | |
| C�� | VA���⻯��ķе������� | |
| D�� | ��A������������Ӧˮ�������������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� | CH3COOH | HCN | HF | H2CO3 |
| ���볣�� | 1.8��10-5 | 4.9��10-10 | 6.6��10-4 | Ka1=4.3��10-2Ka2=5.6��10-11 |
| A�� | 5��������ҺpH��С��ϵpH��Na2CO3����pH��NaCN����pH��NaHCO3����pH��CH3COONa����pH��NaF�� | |
| B�� | 2mol•L-1HCN��1mol•L-1NaOH��Һ�������Ϻ����Һ�У�c��CN-����c��Na+����c��HCN�� | |
| C�� | ��Na2CO3��Һ�еμӹ�����HCN��Һ��2HCN+Na2CO3=2NaCN+CO2��+H2O | |
| D�� | �������ʵ�����Na2CO3��NaHCO3�Ļ��Һ�У�2c��Na+��=3c��CO32-��+3C��HCO3-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������͵���-KI��ֽ��������е�KIO3��IO3-+5I-+6H+=3I2+3H2O | |
| B�� | CO��g����ȼ������283.0kJ/mol����2CO2��g��=2CO��g��+O2��g����H=-566.0KJ/mol | |
| C�� | Fe��OH��3��������Fe��OH��3+3H+=Fe3++3H2O | |
| D�� | ��ij������Һ�к��е����ʵ�����Cl-��I-��AlO2-��CO32-��NO3-��SiO32-�������֣����������������������ݣ���Һ��ɫ���ܣ�����Һ��һ����CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH | B�� | KI | C�� | NH3 | D�� | Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ж��ֻ�����������ơ��������ơ��������ơ�̼���ơ�̼�����Ƶȵȣ���Щ������ʵ���������й㷺��Ӧ�ã�һ������������ܽ���ת����������м��㣺
���ж��ֻ�����������ơ��������ơ��������ơ�̼���ơ�̼�����Ƶȵȣ���Щ������ʵ���������й㷺��Ӧ�ã�һ������������ܽ���ת����������м��㣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com