
一定条件下存在反应C(s)+H2O(g)  CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1 ℃ | T2 ℃ | T1 ℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V>0.5L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1< T2
A
【解析】
试题分析:A.甲容器中,反应在前15 min的平均速率v(CO)= 1.5mol/L÷15 min =0.1mol/(L?min),由于v(CO)=v(H2),所以v(H2)=0.1 mol·L-1·min-1,正确;B.对于丙来说,反应温度与甲相同,开始加入的物质的物质的量是甲的2倍,达到平衡时各种物质的物质的量浓度也是甲的2倍,说明增大物质的浓度平衡没有发生移动。由于该反应是反应前后气体体积不等的反应,说明丙容器的体积V=0.5L,错误;C.根据甲可知,当反应达到平衡时,各种物质的浓度分别是:c(H2)=c(CO)= 1.5mol/L;c(H2O)= (1 mol÷0.5 L)- 1.5mol/L=0. 5mol/L,所以在T1 ℃时,反应的平衡常数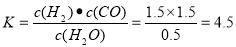 ,错误;D.对于乙容器中,若平衡时n(H2O)=0.4 mol,则c(H2O)=0.8 mol/L,c(H2)=c(CO)= 1.2mol/L;达到平衡时,
,错误;D.对于乙容器中,若平衡时n(H2O)=0.4 mol,则c(H2O)=0.8 mol/L,c(H2)=c(CO)= 1.2mol/L;达到平衡时, <4.5,说明平衡逆向移动,由于该反应的正反应是吸热反应,根据平衡移动原理,降低温度,平衡向放热反应方向移动,所以T1>T2,错误。
<4.5,说明平衡逆向移动,由于该反应的正反应是吸热反应,根据平衡移动原理,降低温度,平衡向放热反应方向移动,所以T1>T2,错误。
考点:考查化学平衡产生的计算、外界条件对化学平衡、化学反应速率的影响的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
5.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O  KIO3+3H2↑。下列有关说法不正确的是(相对原子质量:K:39,I:127,O:16)
KIO3+3H2↑。下列有关说法不正确的是(相对原子质量:K:39,I:127,O:16)
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I――6e-+3H2O=IO3-+6H+
C.当电解过程中转移3mole-时,理论上可制得KIO3 107g
D.电解前后溶液的pH几乎不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都郫县高三第二次阶诊断性考试理综化学试卷(解析版) 题型:填空题
(14分)以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下:

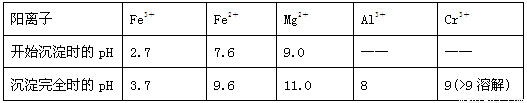
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:
__________________________________、____________________________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?请用必要的文字和离子方程式解释:_______________________________________________________。
(4)流程图中“□”内的操作是___________________、______________________、 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、M、W在元素周期表中的相对位置如图,其中Z的核电荷数是Y 的两倍.下列说法正确的是

A.M位于元素周期表中第三周期ⅣA族
B.原子半径:Z>M>X
C.气态氢化物的热稳定性:Y>X>W
D.W的氧化物既能与NaOH反应,也能与HF反应,属于两性氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:填空题
(15分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ?H =a kJ/mol (I)
NaNO3(s)+ClNO(g) K1 ?H =a kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ?H =b kJ/mol (II)
2ClNO(g) K2 ?H =b kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),?H= kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),?H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后
n(Cl2)= mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数K2 (填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2-)和c(CH3COO?)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol?L?1,CH3COOH的电离常数K a=1.7×10-5mol?L?1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图。下列有关说法正确的是

A.转移0.1mol电子时,a电极产生标准状况下O2 1.12L
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
常温下在下列给定条件的溶液中,一定能大量共存的离子组是
A.中性溶液:Cu2+、Al3+、NO3-、SO42-
B.加入苯酚显紫色的溶液:K+、NH4+、Cl-、NO3-
C.加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42-
D.常温下,c(H+)/c(OH一)=1×10 12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:选择题
有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL相同浓度的盐酸(如下图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是

A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C.若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D.最终两溶液中Na+、Cl-的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com