
| A. | $\frac{1}{2}$(10-9+10-11)mol/L | B. | 2×10-11 mol/L | ||
| C. | (10-9+10-11)mol/L | D. | $\frac{1}{2}$(10-5+10-3)mol/L |
分析 先计算混合溶液中c(OH-),再根据Kw=c(OH-).c(H+)计算c(H+).
解答 解:pH=9的溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,pH=11的溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,则等体积混合溶液中c(OH-)=$\frac{1{0}^{-5}+1{0}^{-3}}{2}$mol/L,混合溶液中c(H+)=$\frac{1{0}^{-14}}{\frac{1{0}^{-5}+1{0}^{-3}}{2}}$mol/L≈2×10-11mol/L,故选B.
点评 本题考查了pH的简单计算,根据水的离子积常数进行计算即可,常见的有酸酸混合溶液、酸碱混合溶液、碱碱混合溶液中pH的计算,题目难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
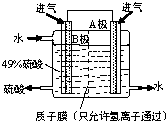 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.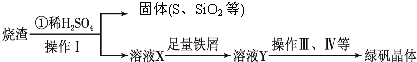
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
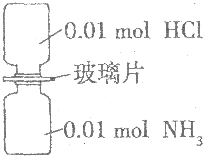 室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的数值)( )
室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的数值)( )| A. | 装置中氢元素的总质量为0.04g | |
| B. | 气体生成物的总体积为0.448 L | |
| C. | 生成物中含有0.01NA个分子 | |
| D. | 生成物完全溶于水后所得溶液含有0.01NA个NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水使酚酞溶液变红的原因:NH3•H2O═NH4++OH- | |
| B. | 硫酸氢钠溶液显酸性:NaHSO4?Na++H++SO42- | |
| C. | 明矾净水原理:Al 3++3 H2O?Al(OH)3↓+3 H+ | |
| D. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4 HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加几滴双氧水后再滴加2滴KSCN溶液,溶液变成血红色,则原溶液中一定含有Fe2+ | |
| B. | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀,则原溶液中一定含有SO42- | |
| C. | 向某溶液中加入稀盐酸产生无色气体,产生的气体使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| D. | 向某溶液中滴加NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定含 有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
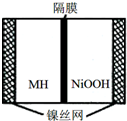 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-+e-═H2O+M | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
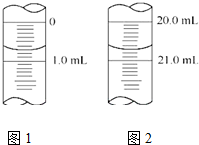 维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HNO3>H2CO3>H2SiO3 | B. | 稳定性;H2S>H2O>HF | ||
| C. | 还原性:Cl->Br->I- | D. | 碱性:NaOH>Mg(OH)2>Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com