
【题目】砷![]() 及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中,回答下列问题:
及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中,回答下列问题:
(1)砷是第四周期ⅤA族元素。下列关于第ⅤA族元素及其化合物的说法不正确的是______(填序号)。
a.沸点:![]() b.酸性:
b.酸性:![]()
c.![]() 的氧化物的水化物是强碱 d.形成的简单离子半径随着原子序数递增而增大
的氧化物的水化物是强碱 d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理为:
①将含砷化合物转化为具有极强还原性的![]() ;
;
②![]() 与
与![]() 溶液反应产生
溶液反应产生![]() 与另一种固体,该反应的离子方程式为____。
与另一种固体,该反应的离子方程式为____。
(3)砷酸![]() 可用于制造杀虫剂、药物。
可用于制造杀虫剂、药物。![]() 溶于稀硝酸中可得砷酸,此反应的化学方程式为________。
溶于稀硝酸中可得砷酸,此反应的化学方程式为________。
(4)利用单质铁处理水体砷污染的原理为:单质铁在水体中被氧化腐蚀得到水合氧化铁[![]() 和
和![]() ],吸附沉降砷的化合物。在其它条件一定时,调节水样的
],吸附沉降砷的化合物。在其它条件一定时,调节水样的![]() ,得到除砷效率曲线如图所示。
,得到除砷效率曲线如图所示。
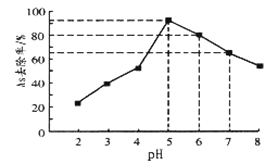
①请解释水样酸性较强时,除砷效率较低的原因是______________。
②国家饮用水标准规定水中砷的含量应低于![]() 。某水样中含砷总浓度为
。某水样中含砷总浓度为![]() ,若控制水样的
,若控制水样的![]() ,出水后的砷浓度______(填“能”或“否”)达到饮用水标准。
,出水后的砷浓度______(填“能”或“否”)达到饮用水标准。
(5)反应![]()
![]() 。在容积为
。在容积为![]() 的密闭容器中进行。起始时
的密闭容器中进行。起始时![]() 和
和![]() 均为
均为![]() 。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
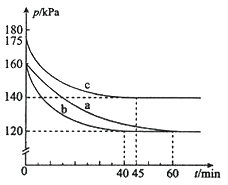
①实验a从反应开始至达到平衡时的反应速率![]() ______(保留两位有效数字)。
______(保留两位有效数字)。
②与实验a相比,其他两组改变的实验条件是:b______、c________。
③用![]() 表示开始时总压强,
表示开始时总压强,![]() 表示平衡时总压强,
表示平衡时总压强,![]() 表示
表示![]() 的平衡转化率,则
的平衡转化率,则![]() 的表达式为____。
的表达式为____。
【答案】c ![]()
![]() 酸性较强时,不易生成水合氧化铁,吸附能力下降,除砷效率低 能
酸性较强时,不易生成水合氧化铁,吸附能力下降,除砷效率低 能 ![]() 使用催化剂 升高温度
使用催化剂 升高温度 ![]() %[或
%[或![]() %]
%]
【解析】
(1)根据元素周期律,用同主族元素性质的递变规律解答;
(2)AsH3被氧化,生成物中有另一种固体,则AgNO3中的Ag+被还原为Ag,根据氧化还原反应的配平原则配平即可;
(3)由题中As2O3溶于稀硝酸中可得砷酸,As的化合价升高,被氧化,则HNO3被还原,由此可写出反应方程式;
(4)①单质铁处理水体砷污染的原理是:单质铁在水体中被氧化腐蚀得到水合氧化铁,水合氧化铁吸附沉降砷的化合物,结合水合氧化铁的组成分析;
②由图可以看出,当pH=6时,As的去除率为80![]() ,此时溶液中剩余As为20
,此时溶液中剩余As为20![]() ,当水未处理时,水样中含砷总浓度为100μg·L -1,若控制水样的pH=6,水中剩余的As为100μg·L -1
,当水未处理时,水样中含砷总浓度为100μg·L -1,若控制水样的pH=6,水中剩余的As为100μg·L -1![]() =0.02mg/L,据此判断;
=0.02mg/L,据此判断;
(5)①依据起始时,AX3和X2均为0.2mol,结合压强变化求算出AX3的变化量,就可得v(AX5);
②根据图中曲线的变化,结合反应的特点,可以得出结论;
③依据反应前后压强的变化,通过列三行式,求算![]() ;
;
(1)N、P、As处于同主族,按N、P、As的顺序,原子序数递增,依据同主族元素随原子序数递增,非金属性递减,可知非金属性N![]() P
P![]() As。
As。
a.因为NH3分子间存在氢键,而PH3分子间无氢键,所以:沸点NH3![]() PH3,故a正确;
PH3,故a正确;
b.元素的非金属性越强,最高价氧化物的水化物的酸性越强,所以:酸性HNO3![]() H3AsO4,故b正确;
H3AsO4,故b正确;
c. As是非金属元素,所以其氧化物的水化物不可能是强碱,故c错误;
d.同主族元素,原子序数递增,电子层数递增,原子半径递增,形成的简单离子的半径也是递增的,故d正确;
本题答案为c。
(2)由分析可知,反应的离子方程式为:2AsH3![]() 12Ag+
12Ag+![]() 3H2O=As2O3
3H2O=As2O3![]() 12H+
12H+![]() 12Ag,本题答案为:2AsH3
12Ag,本题答案为:2AsH3![]() 12Ag+
12Ag+![]() 3H2O=As2O3
3H2O=As2O3![]() 12H+
12H+![]() 12Ag。
12Ag。
(3)由题中As2O3溶于稀硝酸中可得砷酸,As的化合价升高,被氧化,则HNO3被还原,所以As2O3溶于稀硝酸中可得砷酸,反应的化学方程式为3As2O3![]() 4HNO3
4HNO3![]() 7H2O=6H3AsO4
7H2O=6H3AsO4![]() 4NO
4NO![]() ;本题答案为:3As2O3
;本题答案为:3As2O3![]() 4HNO3
4HNO3![]() 7H2O=6H3AsO4
7H2O=6H3AsO4![]() 4NO
4NO![]() 。
。
(4)①单质铁处理水体砷污染的原理是:单质铁在水体中被氧化腐蚀得到水合氧化铁,水合氧化铁吸附沉降砷的化合物,若酸性较强,单质铁容易被腐蚀,不易生成水合氧化铁,吸附能力下降,除砷效率低;本题答案为:酸性较强时,不易生成水合氧化铁,吸附能力下降,除砷效率低。
②由图可以看出,当pH=6时,As的去除率为80![]() ,此时溶液中剩余As为20
,此时溶液中剩余As为20![]() ,当水未处理时,水样中含砷总浓度为100μg·L -1,若控制水样的pH=6,水中剩余的As为100μg·L -1
,当水未处理时,水样中含砷总浓度为100μg·L -1,若控制水样的pH=6,水中剩余的As为100μg·L -1![]() =0.02mg/L
=0.02mg/L![]() 0.05mg/L,能达到饮用水标准;本题答案为:能。
0.05mg/L,能达到饮用水标准;本题答案为:能。
(5)①起始时AX3和X2均为0.2mol,即n0=0.4mol,总压强为160KPa,平衡时总压强为120KPa,设平衡时总物质的量为n,根据压强之比等于物质的量之比有n=0.30mol。根据反应进行如下计算: 设生成AX5的量为x,,则(0.20-x)+(0.20-x)+x=0.30,x=0.10,所以实验a从反应开始至达到平衡时的反应速率v(AX5)=![]() mol/(L·min)=1.7×10-4 mol/(L·min),本题答案为:1.7×10-4 mol/(L·min)。
mol/(L·min)=1.7×10-4 mol/(L·min),本题答案为:1.7×10-4 mol/(L·min)。
②对于曲线b,反应速率增大,缩短了达到平衡的时间,而平衡并未移动,由此可知与实验a相比,b加入了催化剂,对于曲线c,和实验a相比,反应速率加快,但平衡向逆反应方向移动,反应容器的容积和起始物质的量未改变,但起始总压强增大,所以是温度升高;本题答案为:催化剂,升高温度。
③用P0表示开始时总压强,P表示平衡时总压强,a表示AX3的平衡转化率,设平衡时总物质的量为n,根据压强之比等于物质的量之比有:P0/P=0.4/n,n=0.4![]() P/P0,据反应进行如下计算:
P/P0,据反应进行如下计算:
AX3(g)![]() X2(g)
X2(g) ![]() AX5(g)
AX5(g)
起始(mol) 0.2 0.2 0
变化(mol) X X X
平衡(mol) 0.2-X 0.2-X X
则(0.2-X)![]() (0.2-X)
(0.2-X)![]() X=n,X=0.4-n=0.4-0.4
X=n,X=0.4-n=0.4-0.4![]() ,则
,则![]() =2(1-p/p0);
=2(1-p/p0);
本题答案为: ![]() %或
%或![]() %。
%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH > 0
B.已知2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热ΔH=-283 kJ
C.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2 溶液反应的反应热ΔH ==2×(-57.3) kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为![]() 的密闭容器内,物质
的密闭容器内,物质![]() 在
在![]() ℃时发生反应,其反应物和生成物的物质的量随时间
℃时发生反应,其反应物和生成物的物质的量随时间![]() 的变化关系如图,下列叙述不正确的是( )
的变化关系如图,下列叙述不正确的是( )
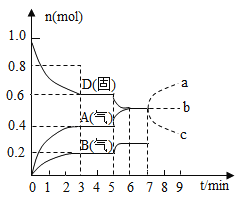
A. 若在第7分钟时增加![]() 的物质的量,则表示
的物质的量,则表示![]() 的物质的量变化正确的是a曲线
的物质的量变化正确的是a曲线
B. 该反应的化学方程式为![]() ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为![]()
C. 已知反应的![]() ,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 从反应开始到第一次达到平衡时,![]() 物质的平均反应速率为
物质的平均反应速率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.σ键一定比π键强度大
B.CO2溶于水和干冰升华都只有分子间作用力改变
C.缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体
D.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1)①-⑦元素中金属性最强的元素位于周期表中的位置为______________________。
(2)③与⑤形成的化合物溶于水会剧烈反应生成白色沉淀和气体A,请写出该反应的化学方程式 ___________________ ,气体A的实验室制备化学方程式为______________。
(3)④所形成的单质与水反应的方程式 _____________,该反应的类型是_______反应。
(4)②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是__________________(用化学式表示);④所在族的各元素与氢气化合所形成的气态氢化物稳定性由强到弱的顺序是(用化学式表示)__________________。
(5)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中进行反应:3H2(g) + N2(g)![]() 2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
A. 10 sB. 20 sC. 30 sD. 40 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com