
【题目】过氧化钠跟足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却残留的固体物质是
A. Na2O2、Na2CO3 B. NaOH、Na2CO3
C. Na2CO3 D. Na2O2、NaOH、Na2CO3
科目:高中化学 来源: 题型:
【题目】在 300 mL 2 mol/L H2SO4 溶液中,SO![]() 的物质的量浓度是________,H+ 的物质的量浓度是________,溶质的质量是________,此溶液中含 H+ 的物质的量是________。
的物质的量浓度是________,H+ 的物质的量浓度是________,溶质的质量是________,此溶液中含 H+ 的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积相同的三个容器里分别充入三种气体①氢气;②二氧化碳;③氧气,并保持三个容器内气体的温度和密度均相等,下列说法正确的是
A. 分子数目:①=②=③ B. 质量关系:①<③<②
C. 压强关系:①>③>② D. 原子数目:②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从金属利用的历史看,先是青铜器时代,而后是铁器时代,铝的冶炼是近百年的事,决定金属使用年代先后顺序的关键因素是( )
A. 金属的活动性 B. 金属的导电性
C. 金属的延展性 D. 地壳中金属元素的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
(4)在1.0l×105Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配置一定体积、一定物质的量的浓度的Na2CO3溶液时,下列情况可能使溶液浓度偏低的是
A. 容量瓶内有少量蒸馏水 B. 溶液从烧杯中转移到容量瓶时,没有洗涤烧杯
C. 定容时观察液面时俯视定容 D. 配溶液的Na2CO3·10H2O晶体在空气中久置风化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是
A. K+、Cu2+、NH4+、OH- B. Na+、SO42-、K+、Cl-
C. Na+、H+、Fe2+、NO3- D. Ba2+、Na+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种措施:
①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:
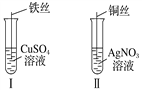
①Ⅰ中铁丝上观察到的现象是______________________;
②Ⅱ中发生反应的离子方程式为_______________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_____________。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热。
①写出制备氢氧化铁胶体的化学方程式____________________.
②向氢氧化铁胶体中逐滴滴入过量盐酸,出现的实验现象为:___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com