
| A、在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 |
| B、酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 |
| C、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| D、由单质A转化为单质B,△H=+119KJ/mol,可知单质A比单质B稳定 |


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
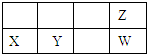
A、X离子结构示意图: |
| B、原子半径Y比Z大 |
| C、元素的气态氢化物的稳定性Z强于W |
| D、X和Y两元素的最高价氧化物的对应水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ |
| B、漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO-3↓+2HClO |
| C、KHSO4熔融状态下电离:KHSO4=K++H++SO42- |
| D、CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入醋酸钠,平衡向左移动 |
| B、加入碳酸钠,平衡向右移动 |
| C、加水稀释,C(H+)减小 |
| D、加水稀释,溶液中仅有的三种离子浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质熔化时不导电,则该物质为弱电解质 |
| B、某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
| C、某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
| D、溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com