
| 3.36L |
| 22.4L/mol |
| 2 |
| 3 |


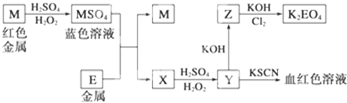
科目:高中化学 来源: 题型:
查看答案和解析>>
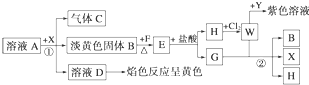
科目:高中化学 来源: 题型:
 硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:

- 4 |
- 2 |
 ═□Mn2++□NO
═□Mn2++□NO- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| B、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、10 L pH=1的硫酸溶液中含有的H+数为2NA |
D、0.5 mol雄黄(As4S4,结构如右图)含有NA个S-S键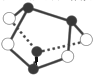 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向盐酸中滴加氨水的过程,可能满足c(H+)>c(NH4+) |
| B、0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、等浓度的NaClO、NaHCO3混合溶液中:c(Na+)=c(ClO?)+c(HClO)+c(HCO3-)+c(H2CO3)+c(CO32-) |
| D、浓度均为0.1mol/L的HA(一元弱酸)和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
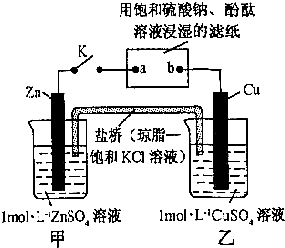
| A、Cu电极上发生还原反应 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后盐桥中Cl-向左移动 |
| D、片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24 | B、40 | C、56 | D、65 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com