

分析 纯碱中常含有少量的NaCl杂质,利用下图的仪器装置可用来测定纯碱Na2CO3的百分含量,需要用空气把装置中空气赶净,生成的二氧化碳全部赶入装置D中吸收,为避免空气中二氧化碳干扰,空气先通过氢氧化钠溶液吸收空气中的二氧化碳,利用剩余气体赶净装置中空气后,从分液漏斗中缓缓滴入稀硫酸和样品中碳酸钠反应生成二氧化碳气体,到不再生成气体,二氧化碳通过装置C中 的浓硫酸干燥进入装置D中 的碱石灰吸收,缓缓通入空气数分钟把生成的二氧化碳全部赶出被装置C吸收,装置E是防止空气中二氧化碳和水蒸气进入装置D影响二氧化碳的测定,最后称量质量计算.
(1)试剂1为氢氧化钠溶液,试剂2为样品,试剂3为稀硫酸,试剂4为浓硫酸,试剂5为碱石灰;
(2)该实验进行至操作e时,要缓缓通入空气数分钟,能使生成的二氧化碳全部被碱石灰吸收;
(3)装置A作用是除去空气中的二氧化碳;
(4)上述实验操作d和e都要“缓缓”进行,能使二氧化碳缓缓通过碱石灰,从而被碱石灰完全吸收;
(5)浓硫酸能够吸收水蒸气,碱石灰吸收空气中二氧化碳和水蒸气,防止空气中CO2、H2O进入D管;
(6)根据提供的数据可以计算纯碱的质量分数,装置D质量变化为生成二氧化碳气体质量,结合碳元素守得到碳酸钠物质的量计算碳酸钠的含量.
解答 解:分析实验过程可知,纯碱中常含有少量的NaCl杂质,利用图中的仪器装置可用来测定纯碱Na2CO3的百分含量,需要用空气把装置中空气赶净,生成的二氧化碳全部赶入装置D中吸收,为避免空气中二氧化碳干扰,空气先通过氢氧化钠溶液吸收空气中的二氧化碳,利用剩余气体赶净装置中空气后,从分液漏斗中缓缓滴入稀硫酸和样品中碳酸钠反应生成二氧化碳气体,到不再生成气体,二氧化碳通过装置C中 的浓硫酸干燥进入装置D中 的碱石灰吸收,缓缓通入空气数分钟把生成的二氧化碳全部赶出被装置C吸收,装置E是防止空气中二氧化碳和水蒸气进入装置D影响二氧化碳的测定,最后称量质量计算.
(1)失水分析可知,试剂1为氢氧化钠溶液,试剂2为样品,试剂3为稀硫酸,试剂4为浓硫酸,试剂5为碱石灰,
故答案为:NaOH溶液; 稀硫酸;浓硫酸;碱石灰;
(2)该实验进行至操作e时,要缓缓通入空气数分钟,能使生成的二氧化碳全部被碱石灰吸收,将反应器中的CO2全部吹出,
故答案为:将反应器中的CO2全部吹出
(3)装置A作用是除去空气中的二氧化碳,如果撤去A,直接向B中缓缓通入空气,则会导致空气中的二氧化碳被碱石灰吸收,从而导致实验测定结果偏大.
故答案为:偏大;
(4)上述实验操作d和e都要“缓缓”进行,理由是使反应产生的二氧化碳能被碱石灰完全吸收;如果这两步做太快,则会导致二氧化碳不能被碱石灰完全吸收,从而导致实验测定结果偏小,
故答案为:速度太快,碱石灰不能完全吸收CO2,使测定结果偏小;
(5)浓硫酸具有吸水性能够吸收二氧化碳气体中水蒸气,碱石灰吸收空气中二氧化碳和水蒸气,防止空气中CO2、H2O进入D管干扰二氧化碳质量测定,
故答案为:干燥CO2;防止空气中CO2、H2O进入D管;
(6)根据提供的数据可以计算纯碱的质量分数,装置D质量变化为生成二氧化碳气体质量,结合碳元素守得到碳酸钠物质的量计算碳酸钠的含量,
设碳酸钠的质量为x,准确称量盛有干燥剂的干燥管D的质量(m1g),然后再称量D的总质量(设为m2g),二氧化碳质量=m2-m1,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
106 44
x (m2-m1)g
x=$\frac{106({m}_{2}-{m}_{1})}{44}$g
纯碱中Na2CO3百分含量的数学表达式=$\frac{\frac{106({m}_{2}-{m}_{1})}{44}}{{n}_{1}}$×100%=$\frac{{106({m_2}-{m_1})}}{{44{n_1}}}×100%$,
故答案为:$\frac{{106({m_2}-{m_1})}}{{44{n_1}}}×100%$.
点评 本题考查了物质含量的测定实验过程分析,气体除杂、气体质量测定方法及其注意问题等,合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合物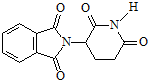 的分子式为C13H9O4N2 的分子式为C13H9O4N2 | |
| B. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH | |
| C. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| D. | 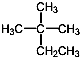 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | I2+SO2+2H2O═H2SO4+2HI | ||
| C. | H2O2+H2SO4═SO2+O2↑+H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 | |
| B. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而增大与氢氧化溶液的接触面积,从而加快油脂皂化反应速率 | |
| D. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| D. | 在清洗地板时,84消毒液和洁厕灵(主要成分是盐酸)不能混合使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com