
取物质的量浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为
A.0.01mol·L-1 B.0.017mol·L-1
C.0.05mol·L-1 D.0.50mol·L-1
科目:高中化学 来源: 题型:阅读理解
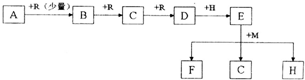
| ||
| ||
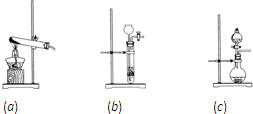
| ||
| ||
| 20V |
| 7 |
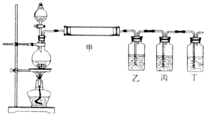
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省潍坊市高三2月月考化学试卷 题型:选择题
下列描述违背化学原理的是( )
A.碳酸钠溶液显碱性,硫酸钠溶液显中性,可判断硫与碳的非金属活动性强弱
B.相同温度时,取物质的量浓度相同的盐酸和乙酸分别滴在PH试纸上,可判断
两者酸性强弱
C.NH4Cl溶于重水(D2O)中,反应生成的一水合氨和水合氢离子分别为NH3·HDO和等D3O+
D.高温时C能置换出SiO2中的Si,说明还原性C比Si强
查看答案和解析>>
科目:高中化学 来源:2010-2011年黑龙江省高二上学期期末考试化学试卷 题型:选择题
取物质的量浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为
A.0.01mol·L-1 B. 0.017mol·L-1
C.0.05mol·L-1 D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com