
| A. | Ag + | B. | NO ${\;}_{3}^{-}$ | C. | Cl- | D. | Ba2+ |
分析 n(AgNO3)=0.005L×0.4mol/L=0.002mol,n(BaCl2)=0.01L×0.3mol/L=0.003mol,发生2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2,以此来解答.
解答 解:n(AgNO3)=0.005L×0.4mol/L=0.002mol,n(BaCl2)=0.01L×0.3mol/L=0.003mol,
由2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2,银离子完全沉淀,n(NO3-)=0.002mol,n(Ba2+)=0.003mol,n(Cl-)=0.003mol×2-0.002mol=0.004mol,溶液体积相同,反应后溶液中离子浓度最大的是Cl-,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意银离子完全沉淀,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol O2含氧原子数为0.5NA | B. | 1.8 g的NH4+中含有的电子数为NA | ||
| C. | 48 g O3含有的氧原子数为NA | D. | 1 mol H2O2中含NA个H2和NA个O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
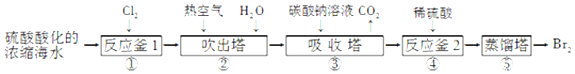
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
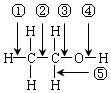 ,乙醇与钠反应时,断开的键是④;与HX反应时,断开的键是③;分子内脱水生成乙烯时,断开的键是①③;分子间脱水生成乙醚时,断开的键是③④;在铜催化作用下发生催化氧化反应时,断开的键是④⑤;酯化反应时,断开的键是④.
,乙醇与钠反应时,断开的键是④;与HX反应时,断开的键是③;分子内脱水生成乙烯时,断开的键是①③;分子间脱水生成乙醚时,断开的键是③④;在铜催化作用下发生催化氧化反应时,断开的键是④⑤;酯化反应时,断开的键是④.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
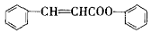 )是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
)是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
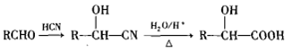
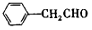 .
.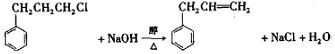 .
. .
. 或
或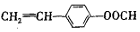 .(任写一种)
.(任写一种)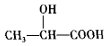 )的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
)的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com