
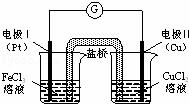
如图是某同学设计的原电池装置,下列叙述中正确的是( )
|
| A. | 电极Ⅰ上发生还原反应,作原电池的负极 |
|
| B. | 电极Ⅱ的电极反应式为:Cu2++2e﹣=Cu |
|
| C. | 该原电池的总反应为:2Fe3++Cu=Cu2++2Fe2+ |
|
| D. | 盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
| 原电池和电解池的工作原理.. | |
| 专题: | 电化学专题. |
| 分析: | 该原电池中,铜电极易失电子发生氧化反应而作负极,铂电极上铁离子得电子发生还原反应,则铂电极是正极,盐桥的作用是平衡正负极两池的电荷. |
| 解答: | 解:A.电极Ⅰ铂电极上铁离子得电子发生还原反应,所以铂电极作正极,故A错误; B.电极Ⅱ铜电极上铜失电子发生氧化反应,电极反应式为:Cu﹣2e﹣═Cu2+,故B错误; C.该原电池负极上铜失电子,正极上铁离子得电子,所以其电池反应式为2Fe3++Cu═Cu2++2Fe2+,故C正确; D.盐桥的作用是平衡正负极两池的电荷,盐桥中离子的定向移动形成电流,电子不能通过电解质溶液,故D错误; 故选C. |
| 点评: | 本题考查原电池原理,明确正负极上得失电子是解本题关键,知道盐桥的作用,注意电子不进入电解质溶液和盐桥中,为易错点,题目较简单. |


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,5.6 L CH4含C—H键数目为NA
B.常温常压下,100 g 17% H2O2水溶液含氧原子总数为NA
C.标准状况下,5.6 L O2与适量Na加热反应,转移电子数一定为NA
D.常温常压下,14 g乙烯与丙烯的混合气体,含碳原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
120℃、101.3kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A.2∶1 B.1∶2 C.1∶7 D.7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | 分子式为C5H10O2的羧酸共有3种 |
|
| B. | 分子式为C3H9N的异构体共有4个 |
|
| C. | 某烷烃CnH2n+2的一个分子中,含有共价键的数目是3n+1 |
|
| D. | 某烷烃CnH2n+2的一个分子中,含有非极性键的数目是n﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释实验事实的方程式不正确的是( )
|
| A. | 葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖) |
|
| B. | 向AgNO3溶液中加入过量Na2S溶液后,再加NaCl稀溶液,黑色沉淀变成白色:Ag2S+2Cl﹣=2AgCl↓+S2﹣ |
|
| C. | 将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O⇌NH3•H2O⇌NH4++OH﹣ |
|
| D. | 明矾的水溶液pH<7:Al3++3H2O⇌Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法中,不正确的是
A.钢铁在潮湿空气中生锈属于电化学腐蚀
B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀
C.金属腐蚀的本质是金属原子失去电子被氧化的过程
D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是 。(2)吸收塔中的原料B可以选用 (填字母序号)。
a.NaCl溶液 b.Na2CO3溶液 c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3 的过程(加热装置已略去)。

① A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是 。装置B的作用是 。
② C中制备Na2S2O3发生的连续反应有:Na2S + H2O + SO2 ===Na2SO3 +H2S、
和 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH 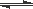 CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
A.温度升高,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量醋酸钠固体,CH3COOH溶液的电离度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com