
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为
_____,I和Cl相比,电负性较大的是_____。
(2)基态溴原子的电子排布式为_____,碘原子价电子的电子排布图为_____。
(3)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______,中心I原子的杂化轨道类型为
__________。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。
(5) 离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm( pm=10-12m), RbICl2晶胞中含有______个氯原子,RbICl2晶体的密度是_____g•cm3(只要求列箅式,不必计算出数值。阿伏伽德罗常数为NA)。
(15分 )(1)IBr>ICl>Cl2(2分) Cl(1分)
(2)[Ar]3d104s24p5(2分) 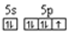 (2分) (3)V形(1分) sp3(1分)
(2分) (3)V形(1分) sp3(1分)
(4)①②③(2分) (5) 8(2分) 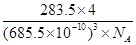 (2分)
(2分)
【解析】
试题分析:(1)卤素单质形成的晶体均是分子晶体,分子间作用力越大,沸点越高。则Cl2、IBr、ICl沸点由髙到低的顺序为IBr>ICl>Cl2;非金属性越强,电负性越大,则I和Cl相比,电负性较大的是Cl。
(2)溴元素的原子序数是35,所以根据构造原理和能量最低原理可知,基态溴原子的电子排布式为[Ar]3d104s24p5;I的原子序数是53,则碘原子价电子的电子排布图为 。
。
(3)因为I3+可看成II2+,所以根据价层电子对互斥理论可知,I3+中中心原子含有的孤对电子对数=(7-1-2×1)÷2=2,所以其空间构型为V形,其中I原子的杂化轨道类型是sp3杂化。
(4)由于非金属性Cl>Br>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强。在②③中都是碘元素的含氧酸,非羟基氧个数越多,酸性越强,则酸性为②>③,故三种物质的酸性由强到弱的顺序为①②③。
(5)离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,所以晶体中阴离子数目为8×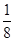 +6×
+6×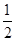 =4个,则根据该化合物的化学式可知,含有的氯原子数目是4×2=8个。根据
=4个,则根据该化合物的化学式可知,含有的氯原子数目是4×2=8个。根据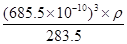 ×NA=4,解得ρ=
×NA=4,解得ρ=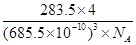 。
。
考点:考查核外电子排布、电负性、空间构型、杂化轨道类型、含氧酸酸性以及晶体结构的有关计算等


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:


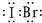
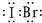
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com