

| 0.051g |
| 0.2g |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、CrO3是氧化剂 |
| B、该反应为复分解反应 |
| C、反应中转移的电予数为6e- |
| D、C2H5OH中碳元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、浓硫酸能与铜反应,说明浓硫酸有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
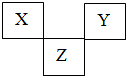 X、Y、Z是VA→VIIA族的三种短周期元素,他们在周期表中的位置如图所示.
X、Y、Z是VA→VIIA族的三种短周期元素,他们在周期表中的位置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盛放氢氧化钠溶液的试剂瓶用橡皮塞,不用玻璃塞 |
| B、常温下可用铁、铝制容器盛放浓硫酸或浓硝酸,因为它们不反应 |
| C、N2和H2合成NH3,属于氮的固定 |
| D、丁达尔效应是检验胶体和溶液的一种常用方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com