
| A. | 氯酸钾分解制氧气 | B. | 氯化铵分解得氨气 | ||
| C. | 碳酸钙分解得二氧化碳 | D. | 实验室制备氢气 |
分析 △H小于零表示该反应为放热反应.常见的放热反应有:所有的物质燃烧反应、所有金属与酸的反应、常温下,金属和水的反应、所有的中和反应、绝大多数的化合反应、置换反应、少数分解、复分解反应等.
解答 解:A.氯酸钾分解制氧气,是分解反应,是吸热反应,故A错误;
B.氯化铵分解得氨气,是分解反应,是吸热反应,故B错误;
C.碳酸钙分解得二氧化碳,是分解反应,是吸热反应,故C错误;
D.实验室制备氢气是用活泼金属与酸反应,属于放热反应,故D正确;
故选D.
点评 本题考查了反应热与焓变的概念,题目难度不大,平时学习应注重归纳中学化学中常见的吸热或放热的反应,试题有利于培养学生的分析、理解能力及对化学知识的应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 在0-50min之间,pH=2和pH=7时R的降解百分率不相等 | |
| B. | 溶液酸性越强,R的降解速率越小 | |
| C. | R的起始浓度和溶液的pH均影响R的降解速率 | |
| D. | 在 20-25min之间,pH=10 时R的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 | |
| B. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| C. | 放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 | |
| D. | 断开化学键的过程会放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
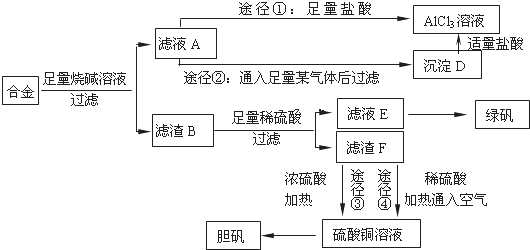
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol•L-1的NaOH标准溶液 | |
| B. | 催化剂可以加快化学反应速率但不能改变化学反应的焓变 | |
| C. | 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1mL饱和氯化铁溶液逐滴加入到20mL温水中,边加边搅拌 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体和溶液 | |
| D. | 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、SO42-、NO3- | B. | K+、Na+、SO42-、Ba2+ | ||
| C. | K+、MnO4-、NH4+、Cl- | D. | Cu2+、K+、HCO3-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com