
ЎҫМвДҝЎҝұҪјЧИ©ЈЁОўИЬУЪЛ®ЎўТЧИЬУЪУР»ъИЬјБЈ¬ГЬ¶ИФјөИУЪЛ®өДГЬ¶ИЈ©ФЪјоРФМхјюПВ·ўЙъЖз»Ҝ·ҙУҰҝЙТФЦЖұёұҪјЧҙјЈЁФЪЛ®ЦРИЬҪв¶ИІ»ҙуЎўТЧИЬУЪУР»ъИЬјБЈ¬ГЬ¶ИФјөИУЪЛ®өДГЬ¶ИЈ©әНұҪјЧЛбЎЈ·ҙУҰФӯАнИзПВЈә2C6H5CHO+NaOHЎъC6H5CH2OH+C6H5COONaЎўC6H5COONa+HClЎъC6H5COOH+NaClЈ¬УР№ШОпЦКОпАнРФЦКИзұнЈә
ұҪјЧИ© | ұҪјЧҙј | ұҪјЧЛб | ұҪ | |
·Рөг/Ўж | 178 | 205 | 249 | 80 |
ИЫөг/Ўж | 26 | ©Ғ15 | 12 | 5.5 |
ұҪјЧЛбФЪЛ®ЦРөДИЬҪв¶И | ||
17Ўж | 25Ўж | 100Ўж |
0.21 g | 0.34 g | 5.9 g |
КөСйБчіМИзПВЈә
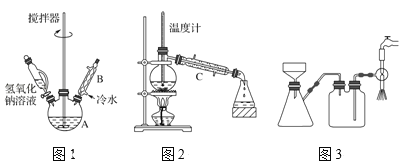
ЈЁ1Ј©өЪўЩІҪРиБ¬РшјУИИ1РЎКұЈЁИзНј1Ј©Ј¬ЖдЦРјУИИәН№М¶ЁЧ°ЦГОҙ»ӯіцЎЈИфҪ«ТЗЖчBёДОӘТЗЖчCЈ¬Р§№ыІ»ИзBЈ¬ЛөГчФӯТт________ЎЈ
ЈЁ2Ј©ІЩЧчЦРУР№Ш·ЦТәВ©¶·өДК№УГІ»ХэИ·өДКЗ___ЎЈ
AЈ®·ЦТәВ©¶·ФЪК№УГЦ®З°ұШРлјмІйКЗ·сВ©Л®
BЈ®·ЦТәВ©¶·ДЪөДТәМеІ»ДЬ№э¶аЈ¬·сФтІ»АыУЪХсөҙ
CЈ®ід·ЦХсөҙәуҪ«·ЦТәВ©¶·ЦГУЪМъјЬМЁЙПҫІЦГЈ¬·ЦІгәуБўјҙҙтҝӘРэИыҪшРР·ЦТә
DЈ®·ЦТәКұөИПВІгТәМе·ЕНкәуБўјҙ№ШұХРэИыЈ¬»»Т»ёцЙХұӯФЩҙтҝӘРэИыК№ЙПІгТәМеБчПВ
ЈЁ3Ј©ІЩЧчўЫУГ·РЛ®ФЎјУИИХфБуЈ¬ФЩҪшРРІЩЧчўЬЈЁИзНј2Ј©Ј¬КХјҜ___ЎжөДБу·ЦЎЈНј2ЦРУРТ»ҙҰГчПФҙнОуЈ¬ХэИ·өДУҰёДОӘ_______ЎЈ
ЈЁ4Ј©ійВЛКұЈЁИзНј3Ј©ЙХұӯЦРұҪјЧЛбҫ§МеЧӘИлІјКПВ©¶·КұЈ¬ұӯұЪЙП»№ХіУРЙЩБҝҫ§МеЈ¬УГ___іеПҙұӯұЪЙПІРБфөДҫ§МеЈ¬ійВЛНкіЙәуПҙөУҫ§МеЎЈ
ЈЁ5Ј©УГөзЧУМмЖҪЧјИ·іЖИЎ0.244 0 gұҪјЧЛбСщЖ·УЪЧ¶РОЖҝЦРЈ¬јУ100 mLХфБуЛ®ИЬҪвЈЁұШТӘКұҝЙТФјУИИЈ©Ј¬ФЩУГ0.100 0 molL©Ғ1өДұкЧјNaOHИЬТәөО¶ЁЈ¬№ІПыәДNaOHИЬТә19.20 mLЈ¬ФтұҪјЧЛбСщЖ·өДҙҝ¶ИОӘ___%ЈЁұЈБф4О»УРР§КэЧЦЈ©ЎЈ
Ўҫҙр°ёЎҝBөДҪУҙҘГж»эҙуЈ¬АдИҙ»ШБчұҪјЧИ©өДР§№ыәГ CD 205 ОВ¶ИјЖөДЛ®ТшЗтУҰҙҰУЪХфБуЙХЖҝөДЦ§№ЬҝЪ ВЛТә 96.00
ЎҫҪвОцЎҝ
ёщҫЭБчіМЈәұҪјЧИ©УлNaOHід·Ц·ҙУҰЈ¬УГұҪЭНИЎЙъіЙөДұҪјЧҙјЈ¬·ЦТәЈ¬ЙПІгХфБуҝЙөГұҪјЧҙјЈ¬ПВІгЦчТӘә¬УРұҪјЧЛбДЖЈ¬јУИлСОЛбЦЖөГұҪјЧЛбіБөнЈ¬ійВЛҝЙөГұҪјЧЛбЈ¬
ЈЁ1Ј©ёщҫЭТЗЖч№№ФмҝЙөГЈ»ЗтРОАдДэ№ЬҪУҙҘГж»эҙуЈ¬АдДэР§№ыёьәГЈ»
ЈЁ2Ј©ёщҫЭ·ЦТәВ©¶·өДІЩЧчК№УГ·ЦОцЈ»
ЈЁ3Ј©ёщҫЭұҪјЧҙјөД·РөгҝЙөГЈ»ХфБуКұЈ¬ОВ¶ИјЖІвБҝөДКЗұҪјЧҙјХфЖшөДОВ¶ИЈ¬ЛщТФОВ¶ИјЖөДЛ®ТшЗтУҰҙҰУЪХфБуЙХЖҝөДЦ§№ЬҝЪҙҰЈ»
ЈЁ4Ј©ҝјВЗјхЙЩҫ§МеөДЛрК§Ј»
ЈЁ5Ј©ёщҫЭ»ҜС§·ҙУҰC6H5COOH+NaOHЎъC6H5COONa+H2OЈ¬·ҙУҰПыәД0.1000mol/LNaOHИЬТә19.20mLЈ¬ОпЦКөДБҝОӘ0.1000mol/LЎБ0.0192L=0.00192molЈ¬ФтұҪјЧЛбЦРұҪјЧЛбөДЦКБҝ=0.00192molЎБ122g/mol=0.23424gЈ¬ҫЭҙЛјЖЛгЎЈ
(1)ТЗЖчBОӘЗтРОАдДэ№ЬЈ¬ТЗЖчCОӘЦұРРАдДэ№ЬЈ¬BөДҪУҙҘГж»эҙуЈ¬АдИҙ»ШБчұҪјЧИ©өДР§№ыәГЈ¬ЛщТФИфҪ«ТЗЖчBёДОӘТЗЖчCЈ¬Р§№ыІ»ИзBЈ¬
№Кҙр°ёОӘЈәBөДҪУҙҘГж»эҙуЈ¬АдИҙ»ШБчұҪјЧИ©өДР§№ыәГЈ»
(2)A. ·ЦТәВ©¶·ЦРУРІЈБ§»оИыЈ¬ФЪК№УГЦ®З°РијмСйКЗ·сВ©Л®Ј¬AПоХэИ·Ј»
B. ·ЦТәВ©¶·ДЪөДТәМеІ»ДЬ№э¶аЈ¬·сФтІ»АыУЪХрөҙЈ¬BПоХэИ·Ј»
C. ФЪРэҝӘРэИыЦ®З°Ј¬УҰёГК№·ЦТәВ©¶·¶ҘІҝ»оИыЙПөД°јІЫ»тРЎҝЧ¶ФЧјВ©¶·өДЙПҝЪҫұІҝөДРЎҝЧЈ¬К№УлҙуЖшПаНЁЈ¬CПоҙнОуЈ»
D. ·ЦТәКұҙэПВІгөДТәМе·ЕНкәуБўјҙ№ШұХРэИыЈ¬»»өфЙХұӯЈ¬ҙУ·ЦТәВ©¶·ЙПҝЪҪ«ЙПІгТәМеө№іцЈ¬DПоҙнОуЈ»
№Кҙр°ёОӘЈәCDЈ»
(3)ІЩЧчўЬөДДҝөДКЗөГөҪұҪјЧҙјөДБу·ЦЈ¬ЛщТФКХјҜ205ЎжөДБу·ЦЈ¬ХфБуКұЈ¬ОВ¶ИјЖІвБҝөДКЗұҪјЧҙјХфЖшөДОВ¶ИЈ¬ЛщТФОВ¶ИјЖөДЛ®ТшЗтУҰҙҰУЪХфБуЙХЖҝөДЦ§№ЬҝЪҙҰЈ»
№Кҙр°ёОӘЈә205Ј»ОВ¶ИјЖөДЛ®ТшЗтУҰҙҰУЪХфБуЙХЖҝөДЦ§№ЬҝЪЈ»
(4)Ҫ«ЙХұӯЦРөДұҪјЧЛбҫ§МеЧӘИлІјКПВ©¶·КұЈ¬ұӯұЪЙПНщНщ»№ХіУРЙЩБҝҫ§МеЈ¬РиСЎУГТәМеҪ«ЙХұӯұЪЙПөДҫ§МеіеПВАҙәуЧӘИлІјКПВ©¶·Ј¬ДҝөДјхЙЩҫ§МеөДЛрК§Ј¬ЛщТФСЎФсіеПҙөДТәМеУҰёГКЗІ»»бК№ҫ§МеИЬҪвЛрК§Ј¬ТІІ»»бҙшИлФУЦКөДЈ¬СЎФсУГВЛТәАҙіеПҙКЗЧоәГөДЈ¬№Кҙр°ёОӘЈәВЛТәЈ»
(5)ёщҫЭ»ҜС§·ҙУҰC6H5COOH+NaOHЎъC6H5COONa+H2OЈ¬·ҙУҰПыәД0.1000mol/LNaOHИЬТә19.20mLЈ¬ОпЦКөДБҝОӘ0.1000mol/LЎБ0.0192L=0.00192molЈ¬ФтұҪјЧЛбЦРұҪјЧЛбөДЦКБҝ=0.00192molЎБ122g/mol=0.23424gЈ¬ЖдЦКБҝ·ЦКэ=![]() ЎБ100%=96.00%Ј»
ЎБ100%=96.00%Ј»
№Кҙр°ёОӘЈә96.00ЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝәПіЙ°ұ№ӨТө¶Ф№ъГсҫӯјГәНЙз»б·ўХ№ҫЯУРЦШТӘөДТвТеЎЈЖдФӯАнОӘЈә
![]() Ј¬ҫЭҙЛ»ШҙрТФПВОКМвЈә
Ј¬ҫЭҙЛ»ШҙрТФПВОКМвЈә
ЈЁ1Ј©ўЩёГ·ҙУҰөД»ҜС§ЖҪәвіЈКэұнҙпКҪОӘK= ЎЈ
ўЪёщҫЭОВ¶И¶Ф»ҜС§ЖҪәвөДУ°Пм№жВЙҝЙЦӘЈ¬¶ФУЪёГ·ҙУҰЈ¬ОВ¶ИФҪёЯЈ¬ЖдЖҪәвіЈКэөДЦөФҪ ЎЈ
ЈЁ2Ј©ДіОВ¶ИПВЈ¬Иф°С10 mol N2Ул30 mol H2ЦГУЪМе»эОӘ10 LөДГЬұХИЭЖчДЪЈ¬·ҙУҰҙпөҪЖҪәвЧҙМ¬КұЈ¬ІвөГ»мәПЖшМеЦР°ұөДМе»э·ЦКэОӘ20ЈҘЈ¬ФтёГОВ¶ИПВ·ҙУҰөДK= (ҝЙУГ·ЦКэұнКҫ)ЎЈ
ДЬЛөГчёГ·ҙУҰҙпөҪ»ҜС§ЖҪәвЧҙМ¬өДКЗ (МоЧЦДё)ЎЈ
aЈ®ИЭЖчДЪөДГЬ¶ИұЈіЦІ»ұд bЈ®ИЭЖчДЪС№ЗҝұЈіЦІ»ұд
cЈ®vХэ(N2)=2vДж(NH3) dЈ®»мәПЖшМеЦРc(NH3)І»ұд
ЈЁ3Ј©¶ФУЪәПіЙ°ұ·ҙУҰ¶шСФЈ¬ПВБРУР№ШНјПсТ»¶ЁХэИ·өДКЗ(СЎМоРтәЕ) ЎЈ

ЈЁ4Ј©ПаН¬ОВ¶ИПВЈ¬УРәгИЭГЬұХИЭЖчAәНәгС№ГЬұХИЭЖчBЈ¬БҪИЭЖчЦРҫщідИл1 mol N2әН3 mol H2Ј¬ҙЛКұБҪИЭЖчөДМе»эПаөИЎЈФЪТ»¶ЁМхјюПВ·ҙУҰҙпөҪЖҪәвЧҙМ¬Ј¬AЦРNH3өДМе»э·ЦКэОӘaЈ¬·ЕіцИИБҝQ1kJЈ»BЦРNH3өДМе»э·ЦКэОӘbЈ¬·ЕіцИИБҝQ2kJЎЈФтЈәa b(МоЎ°ЈҫЎұЎўЎ°ЈјЎұ»тЎ°=ЎұЈ¬ПВН¬)Ј¬Q1 Q2Ј¬Q1 92Ј®4ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝёЯҙҝБтЛбГМЧчОӘәПіЙДшоЬГМИэФӘХэј«ІДБПөДФӯБПЈ¬№ӨТөЙПҝЙУЙМмИ»¶юСх»ҜГМ·ЫУлБт»ҜГМҝуЈЁ»№ә¬FeЎўAlЎўMgЎўZnЎўNiЎўSiөИФӘЛШЈ©ЦЖұёЈ¬№ӨТХИзПВНјЛщКҫЎЈ»ШҙрПВБРОКМвЈә
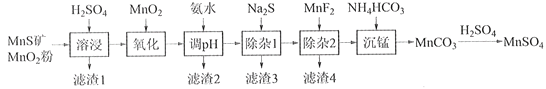
Па№ШҪрКфАлЧУ[c0(Mn+)=0.1 molЎӨL1]РОіЙЗвСх»ҜОпіБөнөДpH·¶О§ИзПВЈә
ҪрКфАлЧУ | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
ҝӘКјіБөнөДpH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
іБөнНкИ«өДpH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
ЈЁ1Ј©Ў°ВЛФь1Ўұә¬УРSәН__________________________Ј»РҙіцЎ°ИЬҪюЎұЦР¶юСх»ҜГМУлБт»ҜГМ·ҙУҰөД»ҜС§·ҪіМКҪ____________________________________________________ЎЈ
ЈЁ2Ј©Ў°Сх»ҜЎұЦРМнјУККБҝөДMnO2өДЧчУГКЗҪ«________________________ЎЈ
ЈЁ3Ј©Ў°өчpHЎұіэМъәНВБЈ¬ИЬТәөДpH·¶О§УҰөчҪЪОӘ_______~6Ц®јдЎЈ
ЈЁ4Ј©Ў°іэФУ1ЎұөДДҝөДКЗіэИҘZn2+әНNi2+Ј¬Ў°ВЛФь3ЎұөДЦчТӘіЙ·ЦКЗ______________ЎЈ
ЈЁ5Ј©Ў°іэФУ2ЎұөДДҝөДКЗЙъіЙMgF2іБөніэИҘMg2+ЎЈИфИЬТәЛб¶И№эёЯЈ¬Mg2+іБөнІ»НкИ«Ј¬ФӯТтКЗ_____________________________________________________________________ЎЈ
ЈЁ6Ј©РҙіцЎ°іБГМЎұөДАлЧУ·ҪіМКҪ___________________________________________________ЎЈ
ЈЁ7Ј©ІгЧҙДшоЬГМИэФӘІДБПҝЙЧчОӘп®АлЧУөзіШХэј«ІДБПЈ¬Жд»ҜС§КҪОӘLiNixCoyMn![]() КұЈ¬z=___________ЎЈ
КұЈ¬z=___________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҝЙДж·ҙУҰ 2NO2(g)![]() N2O4 (g)ФЪМе»эІ»ұдөДГЬұХИЭЖчЦР·ҙУҰЈ¬ҙпөҪЖҪәвЧҙМ¬өДұкЦҫКЗ
N2O4 (g)ФЪМе»эІ»ұдөДГЬұХИЭЖчЦР·ҙУҰЈ¬ҙпөҪЖҪәвЧҙМ¬өДұкЦҫКЗ
ўЩөҘО»КұјдДЪЙъіЙ n mol N2O4 өДН¬КұЙъіЙ 2n mol NO2
ўЪөҘО»КұјдДЪПыәД n mol N2O4өДН¬КұЙъіЙ 2n mol NO2
ўЫ»мәПЖшМеөДЖҪҫщПа¶Ф·ЦЧУЦКБҝІ»ФЩёДұдөДЧҙМ¬
ўЬ»мәПЖшМеөДСХЙ«І»ФЩёДұдөДЧҙМ¬
ўЭУГNO2ЎўN2O4өДОпЦКөДБҝЕЁ¶Иұд»ҜұнКҫөД·ҙУҰЛЩВКөДұИОӘ2Јә1 өДЧҙМ¬
A.ўЩўЬўЭB.ўЪўЭC.ўЩўЫўЬD.ўЩўЪўЫўЬўЭ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПЦУРТФПВОпЦКЈәўЩСОЛбЈ»ўЪ¶юСх»ҜМјЈ»ўЫёЯГМЛбјШЈ»ўЬВБЈ»ўЭЧФАҙЛ®Ј»ўЮКҜД«Ј»ўЯТәСхЈ»ўаөн·ЫЈ»ўбҙҝјо
(1)ТФЙПОпЦКДЬөјөзөДКЗ_______________
(2)ТФЙПОпЦККфУЪөзҪвЦКөДКЗ___________
(3)ТФЙПОпЦККфУЪ·ЗөзҪвЦКөДКЗ_________
(4)ҙУЙПКцОпЦКСЎіцТ»ЦЦ»тјёЦЦҪшРР·ҙУҰЈ¬РҙіцјИКЗСх»Ҝ»№Фӯ·ҙУҰЈ¬УЦКЗ»ҜәП·ҙУҰөД»ҜС§·ҪіМКҪЈә____________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ(1)РҙіцПВБРУР»ъОпөДПөНіГьГы»тҪб№№јтКҪ
ўЩ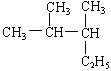 _____________________
_____________________
ўЪ (CH3)2CH(CH2)3CH3 _____________________
ўЫ3,4-¶юјЧ»щ-4-ТТ»щёэНй_____________________
ўЬ2Ј¬3Ј¬4-ИэјЧ»щОмНй_____________________
(2)РҙіцC5H12 өДН¬·ЦТм№№өДҪб№№јтКҪІўУГПөНіГьГы·ЁГьГы_____________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»ҜС§УлҝЖС§ЎўјјКхЎўЙз»бЎў»·ҫіГЬЗРПа№ШЎЈПВБРЛө·ЁҙнОуөДКЗ
A. №шВҜЛ®№ёЦРә¬УРөДCaSO4Ј¬ҝЙПИУГNa2CO3ИЬТәҙҰАнЈ¬әуУГСОЛбіэИҘ
B. ·ПҫЙёЦІДәёҪУЗ°Ј¬ҝЙТАҙОУГұҘәНNa2CO3ИЬТәЎўұҘәНNH4ClИЬТәҙҰАнәёөгҙҰ
C. К№УГә¬УРВИ»ҜДЖөДИЪС©јБ»бјУҝмЗЕБәөДёҜКҙ
D. ОӘ·АЦ№әЈПКёҜАГЈ¬ҝЙҪ«әЈПКІъЖ·ҪюЕЭФЪБтЛбНӯИЬТәЦР
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝўс.іЈОВПВЈ¬Ҫ«ДіТ»ФӘЛбHAәНNaOHИЬТәөИМе»э»мәПЈ¬БҪЦЦИЬТәөДЕЁ¶ИәН»мәПәуЛщөГИЬТәөДpHИзПВұнЈ¬Зл»ШҙрЈә
КөСйұаәЕ | HAОпЦКөДБҝЕЁ¶И(molЎӨL-1) | NaOHОпЦКөДБҝЕЁ¶И(molЎӨL-1) | »мәПИЬТәөДpH |
јЧ | 0.2 | 0.2 | pHЈҪa |
ТТ | c | 0.2 | pHЈҪ7 |
ұы | 0.2 | 0.1 | pHЈҫ7 |
¶Ў | 0.1 | 0.1 | pHЈҪ9 |
ЈЁ1Ј©І»ҝјВЗЖдЛьЧйөДКөСйҪб№ыЈ¬ҙУјЧЧйЗйҝц·ЦОцЈ¬ИзәОУГa (»мәПИЬТәөДpH)АҙЛөГчHAКЗЗҝЛб»№КЗИхЛб________________________________________________________
ЈЁ2Ј©ұыЧйКөСй»мәПИЬТәЦРАлЧУЕЁ¶ИУЙҙуөҪРЎөДЛіРтКЗ_____________________________
ЈЁ3Ј©¶ЎЧйКөСйЛщөГ»мәПИЬТәЦРУЙЛ®өзАліцөДc(OHЈӯ)ЈҪ________________molЎӨL-1Ј¬ »мәПИЬТәЦРЈ¬c(Na+)Јӯc(A-)ЈҪ_________________________molЎӨL-1 (І»ДЬЧцҪьЛЖјЖЛг)ЎЈ
ўт.әПіЙ°ұКЗИЛАаҝЖС§јјКхЙПөДТ»ПоЦШҙуН»ЖЖЈ¬Жд·ҙУҰФӯАнОӘЈәN2ЈЁg)+3H2ЈЁgЈ©![]() 2NH3ЈЁgЈ©H=©Ғ92.4kJmolЈӯ1Ј¬ФЪ773 KКұЈ¬·ЦұрҪ«2 mol N2әН6 mol H2ідИлФЪТ»ёц№М¶ЁИЭ»эОӘ1 LөДГЬұХИЭЖчЦРЈ¬ЛжЧЕ·ҙУҰөДҪшРРЈ¬ЖшМе»мәПОпЦРn(H2)Ўўn(NH3)Ул·ҙУҰКұјдtөД№ШПөИзПВұнЈә
2NH3ЈЁgЈ©H=©Ғ92.4kJmolЈӯ1Ј¬ФЪ773 KКұЈ¬·ЦұрҪ«2 mol N2әН6 mol H2ідИлФЪТ»ёц№М¶ЁИЭ»эОӘ1 LөДГЬұХИЭЖчЦРЈ¬ЛжЧЕ·ҙУҰөДҪшРРЈ¬ЖшМе»мәПОпЦРn(H2)Ўўn(NH3)Ул·ҙУҰКұјдtөД№ШПөИзПВұнЈә
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
ЈЁ1Ј©ҙУ0Ў«10minДЪЈ¬ёГ·ҙУҰөДЖҪҫщЛЩВКv(H2)ЈҪ________________ Ј»ёГОВ¶ИПВЈ¬·ҙУҰҙпөҪ»ҜС§ЖҪәвКұЈ¬»ҜС§ЖҪәвіЈКэK=________________ (ұЈБф¶юО»РЎКэ)
ЈЁ2Ј©ёГОВ¶ИПВЈ¬ИфПтИЭ»эПаН¬өДБнТ»ИЭЖчЦРН¶ИлөДN2ЎўH2ЎўNH3өДЕЁ¶И·ЦұрОӘ3 molЎӨLЈӯ1Ўў3 molЎӨLЈӯ1Ўў3 molЎӨLЈӯ1Ј¬ПВБРёчПоұкЦҫЧЕёГ·ҙУҰҙпөҪ»ҜС§ЖҪәвЧҙМ¬өДКЗ________(МоЧЦДё)ЎЈ
AЈ®ИЭЖчДЪN2ЎўH2ЎўNH3өДЕЁ¶ИЦ®ұИОӘ1ЎГ3ЎГ2 BЈ®3vХэ(N2)ЈҪvДж(H2)
CЈ®ИЭЖчДЪС№ЗҝұЈіЦІ»ұд DЈ®»мәПЖшМеөДГЬ¶ИұЈіЦІ»ұд
ЈЁ3Ј©ёГОВ¶ИПВЈ¬·ЦұрҪ«2 mol N2әН6 mol H2ідИлФЪТ»ёц№М¶ЁИЭ»эОӘ1 LөДГЬұХИЭЖчЦРЈ¬·ҙУҰҙпөҪЖҪәв№эіМЦРЈ¬c(H2)c(N2)c(NH3)ЛжКұјдtұд»ҜИзНјЗъПЯЈ»ФЪҙЛОВ¶ИПВЈ¬ИфЖрКјідИл4 mol N2әН12 mol H2Ј¬Фт·ҙУҰёХҙпөҪЖҪәвКұЈ¬ұнКҫc(H2)Ў«tөДЗъПЯЙППаУҰөДөгОӘ________

Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝYРО№ЬКЗТ»ЦЦМШКвөДТЗЖчЈ¬УлЖдЛыТЗЖчЧйәПҝЙТФҪшРРДіР©КөСйМҪҫҝЎЈАыУГИзНјЧ°ЦГҝЙТФМҪҫҝSO2УлBaCl2·ҙУҰЙъіЙBaSO3іБөнөДМхјюЎЈПВБРЕР¶ПХэИ·өДКЗ
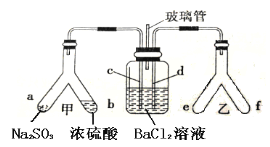
A. eЎўfБҪ№ЬЦРөДКФјБҝЙТФ·ЦұрКЗЕЁ°ұЛ®әНNaOH№ММе
B. ІЈБ§№ЬөДЧчУГКЗБ¬НЁҙуЖшЈ¬К№ҝХЖшЦРөДСхЖшҪшИл№гҝЪЖҝЈ¬ІОУл·ҙУҰ
C. cЎўdБҪёщөј№Ь¶јұШРлІеИлBaCl2ИЬТәЦРЈ¬ұЈЦӨЖшМеУлBa2+ід·ЦҪУҙҘ
D. YРО№ЬТТЦРІъЙъөДОӘСх»ҜРФЖшМеЈ¬Ҫ«BaSO3Сх»ҜОӘBaSO4іБөн
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com