
分析 酸碱中和滴定中,氯化氢的物质的量与氢氧化钠的物质的量相等,即n(HCl)=n(NaOH),设出盐酸的浓度,根据题干数据列式计算出该盐酸的物质的量浓度.
解答 解:设盐酸的物质的量浓度为c,根据反应方程式NaOH+HCl=NaCl+H2O可知:n(HCl)=n(NaOH),
则:c×0.025L=0.1mol/L×0.0245L,
解得:c=0.098mol/L,
答:盐酸的物质的量的浓度为0.098mol/L.
点评 本题通过酸碱中和滴定考查了物质的量浓度的计算,题目难度中等,注意酸碱中和反应的实质,明确物质的量浓度的概念及计算方法,试题有利于通过协商的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:实验题
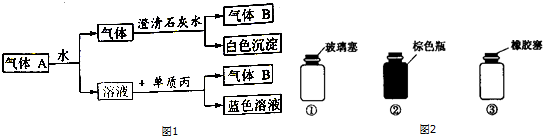
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加水稀释100倍后,硫酸溶液的pH变化比醋酸溶液小 | |
| B. | 两种溶液中,由水电离出的c(H+)=1×10-11mol•L-1 | |
| C. | 与pH=11的NaOH溶液等体积混合后,都恰好中和 | |
| D. | 分别加入足量锌片充分反应后,两溶液中产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b<c<a<d | B. | a<b<c<d | C. | d<a<b<c | D. | c<d<b<a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有脱水性,因而可作干燥剂 | |
| B. | 常温下,浓H2SO4可用铝制密闭容器储运 | |
| C. | 浓H2SO4具有氧化性,稀H2SO4无氧化性 | |
| D. | 浓H2SO4难挥发,因而可在敞口容器中储存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | |
| B. | 单位时间生成2n mol的B同时消耗n mol的D | |
| C. | 混合气体的密度 | |
| D. | A、B、C、D物质的量之比为1:2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com