
| A. | b>a>c | B. | a>c>b | C. | c>a>b | D. | c>b>a |
分析 a、b、c三种元素的原子序数均小于18,其离子的电子层结构相同,原子半径a>c,离子半径b>a,b和c能形成离子化合物,则b位于第二周期为非金属元素,a、c为第三周期元素,且为金属,以此来解答.
解答 解:a、b、c三种元素的原子序数均小于18,其离子的电子层结构相同,原子半径a>c,离子半径b>a,b和c能形成离子化合物,则b位于第二周期为非金属元素,a、c为第三周期元素,且为金属,金属性a>c,原子序数为c>a,综上所述原子序数为c>a>b,
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子和离子半径的比较判断元素的位置为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2O | B. | C3H6O3 | C. | C3H8O3 | D. | C3H6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
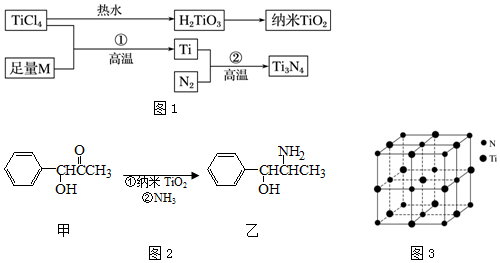
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
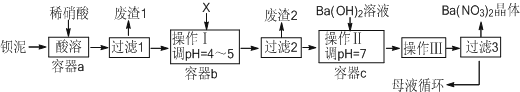
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
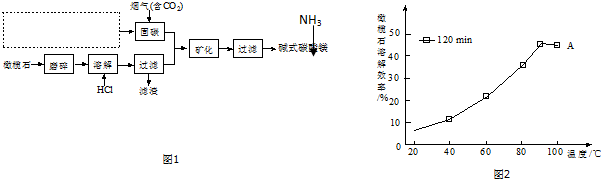
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
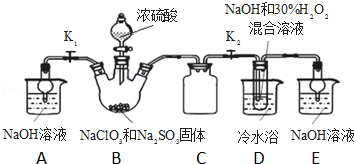
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com