
在一密闭容器中进行如下反应:2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
下列有关金属的说法中,不正确的是( )
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.工业上用电解熔融MgCl2的方法制取金属镁
D.铝是活泼金属,但在空气中耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列递变规律正确的是
A.Na、Mg、Al的金属性依次减弱 B.P、S、Cl元素的最高正价依次降低
C.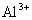 、
、 、
、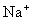 的离子半径依次减小 D.HNO3、H3PO4、H2SO4酸性依次增强
的离子半径依次减小 D.HNO3、H3PO4、H2SO4酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.任何一个能层最多只有s、p、d、f四个能级
B.电子在原子核外的一个空间运动状态称为一个原子轨道
C.氢原子只有一个电子,故氢原子只有一个轨道
D.某元素原子的核外有四个能层,最外能层有1个电子的基态原子共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微
溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等。

下列装置分别是产品的合成装置和精制装置示意图:
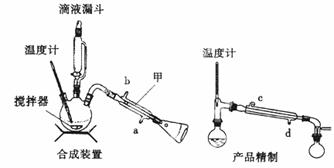
合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2 mL环己醇和25 mL冰醋酸。开动搅拌器,将40 mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5 min。然后,在室温下继续搅拌30 min后,在合成装置中再加入30 mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。
回答下列问题:
(1)在合成装置中,甲装置的名称是 。
(2)三颈烧瓶的容量为 (填“50 mL"、“100 mL”或“250 mL")。
(3)滴液漏斗右边的玻璃导管的主要作用是____________________ 。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是
__________________________________________________________________________;
然后加入精制食盐使之变成饱和溶液,将混合液倒人____ 中,分离得到有机层。
(5)用如上右图对粗产品进行精制,蒸馏收集____ ℃的馏分。
(6)检验坏己酮是否纯净,可使用的试剂为____ 。
A.重铬酸钾溶液 B.金属钠 C.新制的氢氧化铜悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分短周期元素的性质或原子结构如表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟强碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是____(2分)。
(2)元素Y与氢元素形成一种离子YH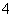 ,写出某溶液中含该微粒的检验方法 (4分)。
,写出某溶液中含该微粒的检验方法 (4分)。
(3)元素Z在周期表中的位置 ___,(2分)元素Z与元素T相比,非金属性较强的是________(2分)(用元素符号表示),下列表述中能证明这一事实的是 (2分)
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
4)探寻物质性质的差异性是学习化学的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是 ,Z的最高价氧化物的水化物与W的最高价氧化物的水化物反应的离子方程式为_______________________。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g) + Y(g)  2Z(g),△H<0,下列叙述正确的是高 考 资 源 网( )
2Z(g),△H<0,下列叙述正确的是高 考 资 源 网( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率:v正(X) = 2v逆(Z)
C.达到平衡后,降低温度,正反应速率减小的倍数小于逆反应减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com