
| A. | 检验溶液中SO42-的方法是:先加入BaCl2溶液,再加盐酸 | |
| B. | 从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 | |
| C. | 硫化钠溶液中通入硫化氢气体不发生化学反应 | |
| D. | 除去CO2中少量HCl的方法是:将混合气体通过盛有饱和NaHSO3溶液的洗气瓶 |
分析 A.检验硫酸根离子时,应该先加入盐酸排除干扰离子,然后再加入氯化钡溶液;
B.溴单质易溶于四氯化碳,微溶于水,可用四氯化碳萃取溴水中溴,然后利用沸点不同蒸馏分离;
C.硫化钠溶液与硫化氢反应生成硫氢化钠;
D.亚硫酸氢钠与氯化氢反应生成二氧化硫气体,引进了新的杂质.
解答 解:A.检验溶液中SO42-,若先加入BaCl2溶液,再加盐酸,生成的沉淀可能为氯化银,干扰了硫酸根离子的检验,应该先加入盐酸,然后再加入氯化钡溶液,故A错误;
B.溴易溶于四氯化碳,从溴水中提纯单质溴,可先用CCl4萃取,然后利用沸点不同用蒸馏法分离出四氯化碳和溴单质,该操作方法合理,故B正确;
C.硫化钠溶液中通入硫化氢气体,二者反应生成硫氢化钠,故C错误;
D.除去CO2中少量HCl,应该将混合气体通过盛有饱和NaHCO3溶液的洗气瓶,否则会引进杂质二氧化硫,故D错误;
故选B.
点评 本题考查化学实验方案的设计与评价,题目难度中等,设计离子检验、萃取、物质的分离与除杂等知识,明确物质分离与除杂原则为解答关键,注意掌握常见离子的检验方法,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | X的氢化物的沸点高于同族其他元素氢化物的沸点 | |
| B. | 阴离子还原性:X>W;阳离子氧化性:Z>Y | |
| C. | X与Y两种元素可形成含有共价键的离子化合物 | |
| D. | Z与W两种元素形成的化合物在水溶液中不能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
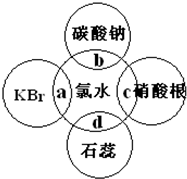 氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量).
氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 向NaOH溶液中滴入少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | Na2CO3溶液中通入CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热空气能吹出溴是利用溴易挥发的性质 | |
| B. | SO2吸收溴的反应方程式:SO2+2H2O+Br2→H2SO4+2HBr | |
| C. | 流程中循环利用的物质有SO2、Br2、Cl2等多种 | |
| D. | 没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅可用于制造光导纤维 | |
| B. | 石英玻璃可用于制造光学仪器 | |
| C. | 玻璃在加热融化时有固定的熔点 | |
| D. | 制普通玻璃的原料是纯碱、石灰石、石英 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气中的CO﹑NO等都是大气污染物 | |
| B. | 氢键﹑离子键﹑共价键都是微粒间的作用力,且属于化学键 | |
| C. | 高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com