
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

填写下列空白:
(1)甲中不含氧原子的官能团是___;下列试剂能与甲反应而褪色的是___(填字母)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:____。
(3)已知:C2H5Br+NaOH![]() CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
淀粉![]() A
A![]() B(C2H5OH)
B(C2H5OH)![]() C(C2H4)
C(C2H4)![]() D(C2H4Br2)
D(C2H4Br2)![]() 乙
乙
①A的分子式是____,试剂X可以是_____。
②写出由D生成乙化学方程式:_______。
(4)已知:
 +HCl(-R为羟基)
+HCl(-R为羟基)
 +H2
+H2
根据已有知识并结合相关信息,写出以苯、乙烯、氯化氢为原料制备丙的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3______。
CH3COOCH2CH3______。
(5)写出丙在引发剂的条件下生成高分子化合物的化学方程式:_____。
【答案】碳碳双键(或![]() ) ac CH2=CHCH2CH2COOH C6H12O6 Br2/CCl4 CH2BrCH2Br+2NaOH
) ac CH2=CHCH2CH2COOH C6H12O6 Br2/CCl4 CH2BrCH2Br+2NaOH![]() CH2OHCH2OH+2NaBr CH2=CH2HCl→CH3CH2Cl
CH2OHCH2OH+2NaBr CH2=CH2HCl→CH3CH2Cl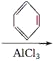
![]()
【解析】
(1)甲中的官能团为碳碳双键和酯基,不含氧原子的官能团为碳碳双键;a项,甲中含有碳碳双键,能与Br2/CCl4溶液发生加成反应使其褪色;b项,石蕊试液不发生颜色变化;c项,甲中含有碳碳双键,能被酸性高锰酸钾溶液氧化,从而使溶液褪色,故答案选ac;
(2)甲的结构简式为![]() ,分子式为
,分子式为![]() ,不饱和度为2,其中不含甲基的羧酸的结构简式为
,不饱和度为2,其中不含甲基的羧酸的结构简式为![]() 、
、![]() 等;
等;
(3)淀粉在浓硫酸、加热的条件下发生水解反应,生成葡萄糖,A为葡萄糖,分子式为![]() 。A在一定条件下生成B,B→C的反应条件为浓硫酸、170℃,为乙醇的消去反应,B为CH3CH2OH,C为乙烯,乙的结构简式为
。A在一定条件下生成B,B→C的反应条件为浓硫酸、170℃,为乙醇的消去反应,B为CH3CH2OH,C为乙烯,乙的结构简式为![]() ,乙中含有两个醇羟基,则试剂X为溴的四氯化碳溶液或者溴水,D的结构简式为
,乙中含有两个醇羟基,则试剂X为溴的四氯化碳溶液或者溴水,D的结构简式为![]() ,D在NaOH溶液中加热发生水解反应生成乙。
,D在NaOH溶液中加热发生水解反应生成乙。
①A的分子式是C6H12O6,试剂X可以是Br2/CCl4或溴水;
②由D生成乙化学方程式为CH2BrCH2Br+2NaOH![]() CH2OHCH2OH+2NaBr;
CH2OHCH2OH+2NaBr;
(4)合成过程为乙烯先与HCl加成生成氯乙烷,然后氯乙烷与苯发生取代反应生成乙苯,乙苯发生消去反应得到丙,即CH2=CH2HCl→CH3CH2Cl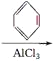
![]() ;
;
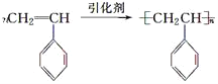
(5)类比乙烯的加聚反应,可写出丙在引发剂的条件下生成高分子化合物的化学方程式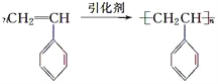 。
。


科目:高中化学 来源: 题型:
【题目】已知反应2Cu+Ag2O=Cu2O+2Ag可设计成如图所示的原电池。普通水泥在固化过程中其自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家利用该电池发明了电动势法测水泥的初凝时间。下列有关说法正确的是( )
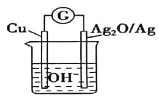
A.电子流动方向从Cu→Ag2O→电解质溶液→Cu,形成闭合回路
B.正极的电极反应式为Ag2O+2H++2e-=2Ag+H2O
C.2molCu与1molAg2O的总能量低于1molCu2O与2molAg的总能量
D.电池工作时,OH-向Cu极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:____。
(2)实验②的化学反应中转移电子的物质的量是____。
Ⅱ.(3)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1mol O3转化为1mol O2和1mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是____(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
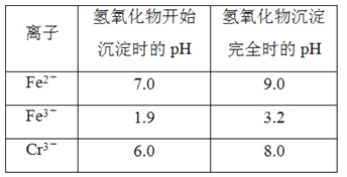
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
(1)某含铬废水处理的主要流程如图所示:
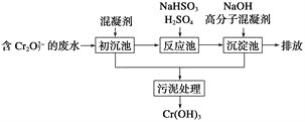
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
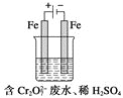
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭恒容容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的密度不再发生变化 ②v正(Y)= 2v逆(X) ③容器中的压强不再发生变化 ④单位时间内生成nmol Z,同时生成2nmolY
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=[(CO2)·(H2)]/[(CO)·(H2O)]在不同的温度下该反应的平衡常数如下表所示:

下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
C. 某温度下,如果平衡浓度符合下列关系式:(CO2)/3(CO)=(H2O)/5(H2),判断此时的温度是1 000 ℃
D. 该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含锌废渣及粉尘是危险废物,碱浸电解法处理可得锌粉。但若其中存在氯,则锌质量就严重下降,对电极板也有严重腐蚀作用。工业上模拟碱浸电解法处理含锌质量分数为16%的废料(主要成分为ZnO、Zn(OH)2、ZnSO4及PbCO3、Fe2O3、Cu杂质)工艺如图:
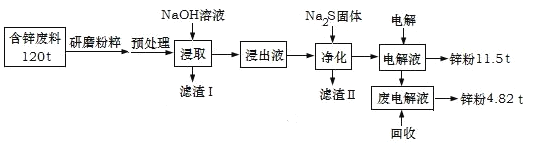
ⅰ.浸出液中含有[Zn(OH)4]2-和[Pb(OH)4]2-等离子
ⅱ.滤渣Ⅱ的主要成分为:Na2Pb(OH)xS![]()
(1)从物质分类的角度看,ZnO属于__,其与NaOH溶液发生反应的离子方程式为__。
(2)“滤渣Ⅰ”的主要成分为___。
(3)下表是“预处理”的2种除氯方案中粉尘氯的去除率和锌损失率分析表格可知,首选的“除氯剂”为___,原因是____。
除氯剂 | 碱(NaOH) | 碳酸钠 |
氯去除率/% | 78.75 | 83.69 |
锌损失率/% | 0.26 | 0.28 |
价格/t | 7200元 | 3600元 |
(4)“电解”过程中阴极的电极反应式为____。
(5)锌的总回收率为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com