
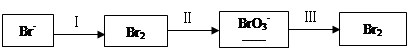
 Na2CO3£½
Na2CO3£½ NaBrO3£«
NaBrO3£« CO2£«
CO2£« ______
______
| Į£×Ó | I2 | Br2 | IO3- |
| ĪļÖŹµÄĮæ/mol | 0.5 | 1.3 | |
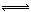 H+£«Cl-£«HClO£¬ Ōö“óc(H+)£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŅÖÖĘCl2ÓėĖ®·“Ó¦
H+£«Cl-£«HClO£¬ Ōö“óc(H+)£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŅÖÖĘCl2ÓėĖ®·“Ó¦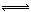 H+£«Cl-£«HClO£¬½µµĶČÜŅŗµÄpH£¬Ōö“óc(H+)£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŅÖÖĘCl2ÓėĖ®·“Ó¦”£
H+£«Cl-£«HClO£¬½µµĶČÜŅŗµÄpH£¬Ōö“óc(H+)£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŅÖÖĘCl2ÓėĖ®·“Ó¦”£


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ģ¼ĖįĒāÄĘÓėĻ”ŃĪĖį·“Ó¦£ŗHCO3”Ŗ+H+=CO2”ü+H2O |
| B£®ĀĮČÜÓŚNaOHČÜŅŗ£ŗAl+2OH”Ŗ=AlO2”Ŗ+H2”ü |
| C£®Ģ¼ĖįĆ¾ÖŠµĪ¼ÓĻ”ŃĪĖį£ŗCO32”Ŗ+2H+=CO2”ü+H2O |
| D£®ĮņĖįĶČÜŅŗÖŠµĪ¼ÓĒāŃõ»Æ±µČÜŅŗ£ŗCu2++2OH”Ŗ=Cu(OH)2”ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®Ķ·ŪÓė98.3%µÄĮņĖį¼ÓČČĻĀ·“Ó¦£ŗCu + 4H+ + SO42£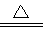 Cu2£«+ SO2”ü+ 2H2O Cu2£«+ SO2”ü+ 2H2O |
B£®µē½ā±„ŗĶŹ³ŃĪĖ®£ŗ2Cl£ +2H+ H2”ü+C12”ü H2”ü+C12”ü |
| C£®ĻņĀČ»ÆĀĮČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®£ŗAl3£«+ 4NH3”¤H2O=[Al(OH)4]£+ 4NH4£« |
| D£®ĮņĖįŃĒĢśČÜŅŗÖŠ¼ÓČėÓĆĮņĖįĖį»ÆµÄ¹żŃõ»ÆĒāČÜŅŗ£ŗ2Fe2++2H++H2O2=2Fe3++2H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ca(HCO3)2ČÜŅŗÓėÉŁĮæNaOHČÜŅŗ·“Ó¦£ŗ 2HCO3££«Ca2£«£«2OH£=CaCO3”ż£«2H2O + CO32- |
| B£®Na2O2ČÜÓŚĖ®²śÉśO2£ŗNa2O2£«H2O=2Na£«£«2OH££«O2”ü |
| C£®ÄĘÓėCuSO4ČÜŅŗ·“Ó¦£ŗ2Na+Cu2+=Cu”ż+2Na+ |
| D£®NaHCO3ČÜŅŗÓėĻ”HCl·“Ó¦£ŗHCO3-+H+=H2O+CO2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®½«SO2ĘųĢåĶØČėNaClOČÜŅŗÖŠ£ŗSO2+2ClO£+H2O =SO32£+2HClO |
| B£®ĻņFeBr2ČÜŅŗÖŠĶØČė¹żĮæCl2£ŗ2Fe2++4Br£+2Cl2=2Fe3++2Br2+4Cl£ |
| C£®ĻņĮņĖįĒā¼ŲČÜŅŗÖŠ¼ÓČėBa(OH)2ČÜŅŗÖĮÖŠŠŌ£ŗ2H++SO42-+Ba2+ +2OH£= BaSO4”ż+2H2O |
| D£®NH4HCO3ČÜŅŗÓė¹żĮæNaOHČÜŅŗ·“Ó¦£ŗNH4++OH£= NH3”ü+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĀČĘųĶØČėĀČ»ÆŃĒĢśČÜŅŗÖŠ£ŗFe2+£«Cl2="=" 2Cl££«Fe3+ |
| B£®ĀČĘųÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦£ŗCl2 + 2OH£="=" Cl£+ ClO£ + H2O |
C£®“óĄķŹÆÓėĻ”ŃĪĖį·“Ó¦£ŗCO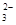 + 2H+== CO2 ”ü + H2O + 2H+== CO2 ”ü + H2O |
D£®ĶÓėĻ”ĻõĖį·“Ó¦£ŗCu + H+ + NO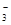 == Cu2+ + NO”ü + H2O == Cu2+ + NO”ü + H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Al3+ | B£®Al(OH)3 | C£®AlO2- | D£®Al3+ŗĶAl(OH)3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com