
| A. | Ca(HCO3 )2与澄清石灰水反应可以表示为:2Ca2++3HCO${\;}_{3}^{-}$+3OH-═2CaCO3↓+CO${\;}_{3}^{2-}$+3H2O | |
| B. | 用Pt电极电解少量的CuC12溶液:2H2O+Cu2++2Cl-═H2↑+Cl2↑+Cu(OH)2↓ | |
| C. | 向CuSO4,溶液中加人Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| D. | 向NaCIO和NaCI混合溶液中滴人少量FeSO4溶液:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
分析 A.碳酸氢钙与氢氧化钙反应生成碳酸钙沉淀和水;
B.电解氯化铜溶液生成铜和氯气;
C.硫酸铜溶液与过氧化钠反应生成氢氧化铜、硫酸钠和氧气;
D.硫酸亚铁少量,铁离子与次氯酸根离子发生双水解反应生成氢氧化铁沉淀.
解答 解:A.Ca(OH)2与Ca(HCO3)2反应生成碳酸钙沉淀和水,正确的离子反应为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故A错误;
B.用Pt电极电解少量的CuC12溶液,反应生成铜和氯气,正确的离子方程式为:Cu2++2Cl-═Cl2↑+Cu,故B错误;
C.向CuSO4溶液中加人Na2O2,反应生成硫酸钠、氢氧化铜沉淀和氧气,反应的离子方程式为:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑,故C正确;
D.NaClO为强碱弱酸盐,水解呈碱性,NaCl为中性,溶液中不存在大量的氢离子,正确的离子方程式为:2Fe2++ClO-+H2O=Fe3++Fe(OH)3↓+Cl-,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
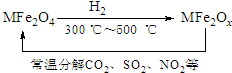 新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图:
新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把SO2通入紫色石蕊溶液中,石蕊溶液 会变红 | |
| B. | 把SO2通入品红溶液中,品红溶液会褪色 | |
| C. | 将足量SO2通入酸性高锰酸钾溶液中,溶液褪色 | |
| D. | 把SO2通入氯化钡溶液中,溶液会出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
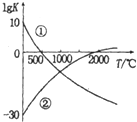 氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:
氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:| A. | 反应①和②均为放热反应 | |
| B. | 升高温度,反应①的反应速率减小 | |
| C. | 在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大 | |
| D. | 在1000℃时,反应①和反应②体系中N2的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在滴加酸碱指示剂酚酞试液后呈现红色的溶液中:Na+、Cl-、AlO2-、CO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中:HCO3-、Al3+、NH4+、ClO- | |
| C. | 在$\frac{c({H}^{+})}{c(0{H}^{-})}$=1×1012的溶液中:Fe2+、Mg2+、CO32-、NO3- | |
| D. | 在AlCl3溶液中:K+、NO3-、S2-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解水实验中,加入硫酸钠可以提高电解效率 | |
| B. | 碳酸氢钠溶液与硫酸铝溶液混合有沉淀和气体生成 | |
| C. | 铁制品在海水中比在纯水中更易腐蚀 | |
| D. | 在双氧水中加FeCl3溶液可使产生O2速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com