


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
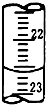 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验,请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验,请完成下列填空:| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
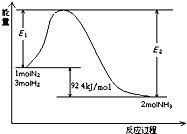
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
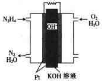 燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:
燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点MgO>NaCl>KCl |
| B、含有金属阳离子的晶体一定是离子晶体 |
| C、同主族元素形成的氧化物的晶体类型均相同 |
| D、沸点:H2O>PH3>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com