
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||


分析 (1)通过比较表格中的数据的异同点进行解答:实验1、2只有温度不同;实验2、3催化剂不同;反应2H2O2═2H2O+O2↑的现象是产生气泡,故反应速率的差异是产生气泡的快慢;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动.
解答 解:(1)①实验1、2只有温度不同,所以研究的是温度对反应速率的影响;实验2、3温度是相同的,而催化剂不同,所以研究的是不同催化剂对反应速率的影响.反应速率快,产生的气体多,气泡就多而快,反应速率慢,产生的气体少,气泡就少而慢,
故答案为:温度;比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异;产生气泡的快慢;
②过氧化氢在FeCl3溶液催化的作用下分解,反应过于剧烈,可控制滴加的量控制反应的速率,分液漏斗带有玻璃活塞,旋转分液漏斗的活塞,控制滴加H2O2溶液的速率,
故答案为:旋转分液漏斗的活塞,控制滴加H2O2溶液的速率;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深;H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动.
点评 本题考查探究影响化学反应速率的影响因素的方法,题目难度中等,明确实验目的为解答关键,注意掌握温度、浓度等因素为反应速率的影响,试题培养了学生的分析能力及化学实验能力.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:选择题
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A.Zn极发生的反应是还原反应
B.正极反应式为2Fe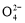 +
+ =Fe2O3+5H2O
=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时 向负极迁移
向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 .
. .
. ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应. (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
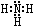 ;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为
;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为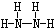 .若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.
.若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )| A. | HR为强电解质 | |
| B. | 图中四点,水的电离程度:c>b>d>a | |
| C. | 若常温时,0.1mol/LHR溶液的电离度为1%,则常温时R+的水解常数约为10-9 | |
| D. | b点溶液中存在c(Na+)=c(R+)+c(HR) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
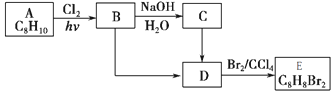
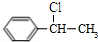 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$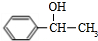 +NaCl
+NaCl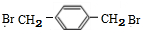 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com