
用粗氧化铜(含少量铁)制纯CuCl2溶液的过程如下:
①取50 mL稀盐酸,加入一定量粗氧化铜,加热、搅拌,充分反应后过滤,经测定溶液pH约为2;
②向滤液中加入双氧水搅拌;
③向滤液中加入过量的纯氧化铜、微热,充分搅拌,经测定溶液的pH约是5;
④过滤;
⑤浓缩溶液。
(1)操作②中的离子方程式:______________________________。
(2)操作④中过滤后滤渣的成分为__________________________。
(3)浓缩过程中溶液颜色的变化:__________________________。
(4)操作③中发生反应的离子方程式为______________________。
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:阅读理解
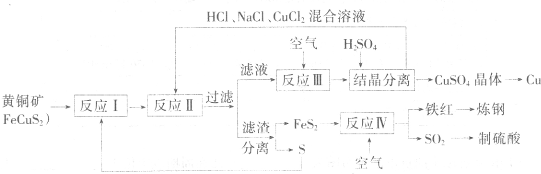
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
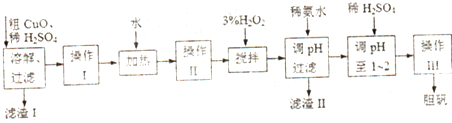
| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀的pH | 2.7 | 7.6 | 5.2 |
| 沉淀完全的pH | 3.7 | 9.6 | 6.4 |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省无锡市高三上学期期中调研考试化学试卷(解析版) 题型:实验题
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:
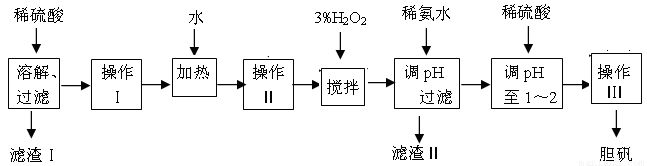
已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
|
|
Fe3+ |
Fe2+ |
Cu2+ |
|
开始沉淀时的pH |
2.7 |
7.6 |
5.2 |
|
完全沉淀时的pH |
3.7 |
9.6 |
6.4 |
(1)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的名称是 ;
H2O2参加反应的离子方程式为 。
(2)加稀氨水调节pH的目的是 ,pH应调至 范围。下列物质可用来替代稀氨水的是 。
①NaOH ②Fe2O3 ③CuO ④Na2CO3
(3)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精致胆矾。两步操作相同,具体包括 、 、
过滤、 、干燥等步骤。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com