
【题目】铁是重要的工业元素。
(1)铁元素位于周期表中的___________区,Fe的外围电子排布的轨道表示式为_____,Fe的7个能级中能量最高的是__________________。
(2)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为______________。写出一种与SO42-互为等电子体的分子的化学式__________________。
(3)金属Fe具有导电性,温度越高其导电性越____________,其原因是__________________。
(4)ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有_________________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键____________________。
(5)某种磁性氮化铁的结构如图所示 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
【答案】 d ![]() 4s 四面体 SiF4(CCl4等) 差 温度升高,自由电子间碰撞加剧导致自由电子的定向移动能力变弱,导电性减小 A、C、E
4s 四面体 SiF4(CCl4等) 差 温度升高,自由电子间碰撞加剧导致自由电子的定向移动能力变弱,导电性减小 A、C、E 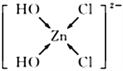 六方最密 Fe3N 12
六方最密 Fe3N 12 ![]()
【解析】(1)铁原子的核电荷数为26,核外电子排布为1s22S22p63s23p63d64s2,铁元素位于周期表中的d区,Fe的外围电子排布的轨道表示式为![]() ;Fe的7个能级中能量最高的是4s;正确答案:d;
;Fe的7个能级中能量最高的是4s;正确答案:d; ![]() ;4s。
;4s。
(2)水分子中价层电子对个数=2+1/2×(6-2×1)=4,VSEPR模型为四面体结构;等电子体是指原子总数相等,电子总数相等,SO42-中有原子5个,电子总数为50个,因此满足与之等电子体的分子有SiF4或CCl4等; 正确答案:四面体;SiF4(CCl4等)。
(3)对于金属来讲,温度升高,自由电子间碰撞加剧导致自由电子的定向移动能力变弱,导电性减小,因此 温度越高铁的导电性越差;正确答案:差;温度升高,自由电子间碰撞加剧导致自由电子的定向移动能力变弱,导电性减小。
(4)[Zn(OH)2Cl2]2-中存在共价键(O-H)、配位键(OH→Zn,Cl→Zn),不存在离子键、金属键和范德华力;OH、Cl与Zn形成4个配位键,结构式为: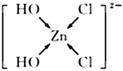 ;正确答案:A、C、E;
;正确答案:A、C、E; 。
。
(5)根据晶胞的结构,可知Fe为六方最密堆积;根据均摊法在氮化铁晶胞中,含有N原子数为2,Fe原子数为2×1/2+12×1/6+3=6,所以氮化铁的化学式Fe3N;其中铁原子最近的铁原子的个数为12;若晶胞底边长为a nm,高为c nm,则晶胞的体积是![]() ,所以这种磁性氮化铁的晶体密度为
,所以这种磁性氮化铁的晶体密度为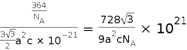 g/㎝3=
g/㎝3=![]() g/㎝3;正确答案:六方最密;Fe3N;12;
g/㎝3;正确答案:六方最密;Fe3N;12; ![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向含有2molSO2的恒容容器中通入过量氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,下列说法中正确的是
2SO3(g) ΔH<0,下列说法中正确的是
A. 氧气过量,所以充分反应后可生成2molSO3
B. 反应达平衡的过程中,混合气体的平均相对分子质量不断减小
C. 反应达平衡后,升高温度,SO2的转化率减小
D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使酚酞显红色的溶液中:Na+、 Al3+、SO42-、Cl-
B. ![]() =1×1012的溶液中:NH4+、Na+、CO32-、SiO32-
=1×1012的溶液中:NH4+、Na+、CO32-、SiO32-
C. c(Fe2+)=1 mol·L-1的溶液中:Mg2+、H+、MnO4-、SO42-
D. 无色透明溶液中:K+、Ca2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)写出漂白粉有效成分的化学式_____。水玻璃的主要成分化学式是_____。
(2)写出醋酸在水溶液中的电离方程式_____。
(3)炼铁、制水泥、玻璃,需要共同的原料是________。
(4)写出镁在二氧化碳中燃烧的化学方程式___________________。
(5)写出二氧化硅与焦炭反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu与CuO的混合物20.8g加到50mL 18.4molL﹣1浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得c(Cu2+)=0.3molL﹣1。(以上过程中硫酸始终是浓硫酸,不考虑气体在水中的溶解)试计算:
(1)反应过程中放出的气体在标准状况下的体积为________L。
(2)溶解稀释后,氢离子的浓度为_________molL﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置从海水中提取CO2,有利于减少环境中温室气体的含量。下列说法正确的是

A. 通电后,a室的pH增大
B. 中间隔室发生的反应:HCO3-+H+==CO2↑+H2O,从而提取CO2
C. 阴极反应式为2H+-2e-==H2↑
D. 当电路中通过1mol电子的电量时,会有22.4LCO2气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如下装置制取和验证SO2的性质。

请回答:
(1)写出图中仪器的名称:a___________,b___________。
(2)棉球中NaOH溶液的作用是______________________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_____________________。
A.紫色石蕊试液 B.无色酚酞试液 C.澄清石灰水 D.碘水
(4)下列说法正确的是____________。
A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B.先向装置中加入试剂(药品),再进行气密性检查
C.实验开始后,洗气瓶①和③只溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)洗气瓶④中发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是( )
A.水银、硫酸、烧碱、硫酸氢钠B.氯水、盐酸、火碱、硫酸钡
C.臭氧、硝酸、纯碱、胆矾D.铜、醋酸、石灰石、氯化铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com