
对下列反应,当后加入的溶液不足或过量时,能用同一个离子方程式表示反应过程的是( )
A.在KHCO3溶液中加入石灰水 B.在Na2SO3溶液中加入稀盐酸
C.在硅单质中加入烧碱溶液 D.在铁粉中加入稀硝酸
科目:高中化学 来源: 题型:阅读理解
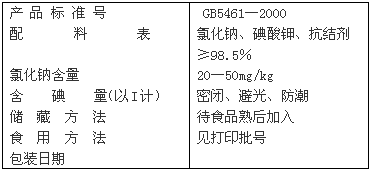
| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡. | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3.再向上述溶液中滴加淀粉溶液,振荡. | 溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
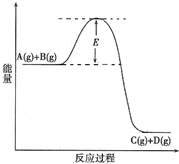 (2010?陕西模拟)已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.
(2010?陕西模拟)已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
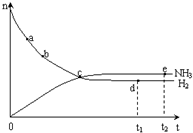 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)中学化学实验中的中和热的测定所需的玻璃仪器除烧杯和温度计外还有 。?
(2)该实验常用0.50 mol·L-1HCl和0.55 mol·L-1?的NaOH溶液各50 mL进行反应。实验中,使NaOH溶液稍过量的主要原因是 。?
(3)若上述HCl、NaOH溶液的密度都近似为1 g·cm-3,若反应前后的温度分别为t1℃、?t2℃,中和后生成的溶液的比热容c =4.18 J/(g·℃),则该中和反应放出热量为 kJ(填表达式),其中和热ΔH? kJ·mol-1(填表达式)。?
Ⅱ.根据科学实验统计,香烟烟雾中有1 000多种化合物。其中至少有300种化合物在不同程度上有毒,如一氧化碳、尼古丁、醛类等。某化学课外活动小组设计实验检验香烟烟雾中存在一氧化碳、尼古丁、醛类等有毒物质。?

如上图,D试管的支管与抽气装置相连,从D试管的支管处抽气,可使A上燃着的香烟的烟雾依次通过A、B、C、D四个装置,且每个装置只能吸收一种物质(A处香烟可连续燃烧)。
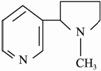
(1)尼古丁的结构如上,在尼古丁结构式中六元环上的一氯取代物有 种。?
(2)若用B装置检验醛类物质,则试管B中盛装的试剂是 。?
(3)已知:在血液中存在下述平衡:?
血红蛋白—O2+CO![]() 血红蛋白—CO+O2?
血红蛋白—CO+O2?
(血红色) (鲜红色)?
若用D装置检验CO的存在,则可采用D试管中加入5 mL新鲜动物血,其实验现象为 。该气体对人体有害,当发生中毒时,可采取的两种措施是① ;② 。依据的原理是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com