
【题目】扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
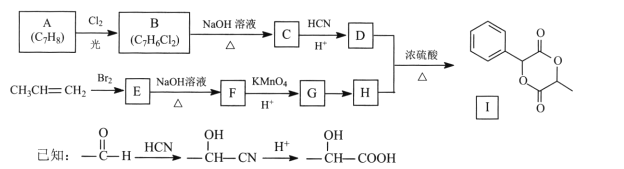
回答下列问题:
(l)C的名称是 ____,I的分子式为____。
(2)E→F的反应类型为____,G中官能团的名称为____ 。
(3) A→B的化学方程式为________。
(4)反应G→H的试剂及条件是________。
(5)写出符合下列条件的D的同分异构体:________。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____。
【答案】苯甲醛 C11H10O4 取代反应(或水解反应) 羰基、羧基 ![]() +2Cl2
+2Cl2![]()
![]() +2HCl H2/Ni,加热
+2HCl H2/Ni,加热 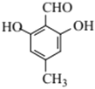 、
、 CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
【解析】
根据流程图,A为甲苯,甲苯与氯气在光照条件下发生侧链的取代反应生成B,因此B为![]() ;B在氢氧化钠溶液中发生水解反应生成C,则C为
;B在氢氧化钠溶液中发生水解反应生成C,则C为![]() ,根据信息,D为
,根据信息,D为![]() ;丙烯与溴发生加成反应生成E,E为1,2-二溴丙烷,E在氢氧化钠溶液中水解生成F,F为
;丙烯与溴发生加成反应生成E,E为1,2-二溴丙烷,E在氢氧化钠溶液中水解生成F,F为![]() ;F被高锰酸钾溶液氧化生成G,G为
;F被高锰酸钾溶液氧化生成G,G为![]() ,G与氢气加成得到H,H为
,G与氢气加成得到H,H为![]() ;
;![]() 与
与![]() 发生酯化反应生成I,加成分析解答。
发生酯化反应生成I,加成分析解答。
(l)根据上述分析,C为![]() ,名称为苯甲醛,I(
,名称为苯甲醛,I(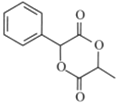 )的分子式为C11H10O4;
)的分子式为C11H10O4;
(2)E→F为1,2-二溴丙烷在氢氧化钠溶液中发生水解反应生成![]() 的反应; G(
的反应; G(![]() )中官能团有羰基、羧基;
)中官能团有羰基、羧基;
(3) 根据上述分析,A→B的化学方程式为![]() +2Cl2
+2Cl2![]()
![]() +2HCl;
+2HCl;
(4)反应G→H为羰基的加成反应,试剂及条件为H2/Ni,加热;
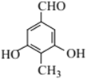
(5) D为![]() ,①能发生银镜反应,说明结构中存在醛基;②与FeC13溶液显紫色,说明含有酚羟基;③核磁共振氢谱峰面积之比1:2:2:3,符合条件的D的同分异构体有
,①能发生银镜反应,说明结构中存在醛基;②与FeC13溶液显紫色,说明含有酚羟基;③核磁共振氢谱峰面积之比1:2:2:3,符合条件的D的同分异构体有 、
、 ;
;
(6) 以溴乙烷为原料制备H(![]() ),需要增长碳链,根据流程图中制备D的分析,可以结合题中信息制备,因此需要首先制备CH3CHO,可以由溴乙烷水解生成乙醇,乙醇氧化生成乙醛,因此合成路线为CH3CH2Br
),需要增长碳链,根据流程图中制备D的分析,可以结合题中信息制备,因此需要首先制备CH3CHO,可以由溴乙烷水解生成乙醇,乙醇氧化生成乙醛,因此合成路线为CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO ![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式: NaHSO4= Na++H++SO42-
C. Na2CO3的水解∶CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. NH4Cl的水解:NH4++H2O = NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以![]() 与
与![]() 为原料合成化肥尿素的主要反应如下:
为原料合成化肥尿素的主要反应如下:
①![]() ;
;![]()
②![]() ;
;![]()
③![]() ;
;![]()
则a为_________。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:
![]() 。
。
若烟气中![]() 时,通入一定量的空气(
时,通入一定量的空气(![]() 体积分数为
体积分数为![]() ),可利用此法达到最佳脱氮效果。则同温同压下,
),可利用此法达到最佳脱氮效果。则同温同压下,![]() _________。
_________。
(3)工业固氮反应中,在其他条件相同时,分别测定![]() 的平衡转化率在不同压强(
的平衡转化率在不同压强(![]() 、
、![]() )下随温度变化的曲线,如图所示正确的是_________(填“A”或“B”),
)下随温度变化的曲线,如图所示正确的是_________(填“A”或“B”),![]() 、
、![]() 的大小关系为
的大小关系为![]() _________
_________![]() (填“>”或“<”或“=”),原因是_________。
(填“>”或“<”或“=”),原因是_________。
A. 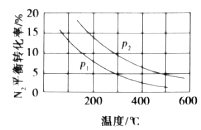 B.
B. 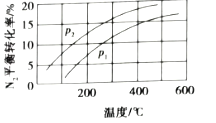
(4)在一定温度下,将![]() 和
和![]() 混合置于
混合置于![]() 密闭容器中发生工业合成氨反应,2分钟达到平衡状态,测得气体总物质的量为
密闭容器中发生工业合成氨反应,2分钟达到平衡状态,测得气体总物质的量为![]() 。
。
①NH3表示该反应的平均速率![]() _________。
_________。
②已知平衡时,容器压强为![]() ,则平衡常数
,则平衡常数![]() _________。(保留2位有效数字)。
_________。(保留2位有效数字)。
(5)电池在生产生活中有广泛的应用,有人设想以![]() 和
和![]() 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________,A是_________(填化学式)。
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________,A是_________(填化学式)。
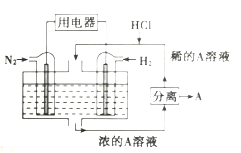
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素的原子半径及主要化合价如下表:
元素 |
|
|
|
|
|
原子半径/ | 0.160 |
| 0.111 | 0.106 | 0.066 |
主要化合价 | +2 | +1 | +2 | +6、-2 | -2 |
下列叙述正确的是( )
A.![]() 一定是金属元素
一定是金属元素
B.原子半径大小:![]()
C.![]() 的简单氢化物的沸点比
的简单氢化物的沸点比![]() 的大
的大
D.![]() 、
、![]() 可能形成阴、阳离子个数比为
可能形成阴、阳离子个数比为![]() 的两种化合物
的两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量稀硫酸(不考虑反应过程中硫酸浓度的变化)中加入一定量的锌粒,同时不断向其中滴加硫酸铜溶液,观察到生成氢气的速率如图所示。下列有关说法错误的是( )
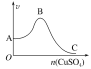
A.AB段速率的变化可能是因为溶液温度逐渐升高
B.AB段速率的变化可能是因为形成了铜锌原电池
C.BC段速率的变化可能是因为溶液温度逐渐降低
D.BC段速率变化的原因主要是置换出的铜太多,覆盖在锌粒表面,阻碍了反应的进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是

A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
①与氯元素同族的短周期元素的原子结构示意图为______。
②能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是____。
a. Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c. HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
③设计一个实验方案,证明氧化性Cl2>Br2:___________。
(2)铅是碳的同族元素,比碳多4个电子层。
①铅在元素周期表的位置为_______。
②PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是____(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2△H<0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2△H<0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)(×10-4mol·L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
C(CO)(×10-3mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
前2s内的平均反应速率v(N2)=______;达到平衡时,NO的转化率为_____,气相中NO所占的体积分数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com