
【题目】常温下,向10.0mL 0.10 mol·L-1某二元酸H2R溶液中滴加入同物质的量浓度的NaOH溶液,测得溶液的pH随NaOH溶液体积的变化如右图所示。下列说法中正确的是
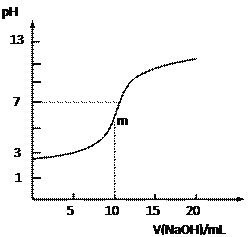
A. 无法判断H2R是强酸还是弱酸
B. 曲线上m点时溶液中c(Na+)>c(HR-) >c(R2-)>c(H+)
C. HR-的电离能力大于水解能力
D. 溶液中c(Na+)+c(H+)=c(HR-)+c(R2-)+c(OH-)
科目:高中化学 来源: 题型:
【题目】t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
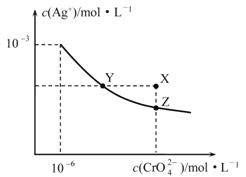
A.在t ℃时,Ag2CrO4的Ksp=1×10-9
B.X点有Ag2CrO4沉淀生成
C.通过加热蒸发可以使溶液由Y点变到Z点
D.在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点变到X点最终变到Z点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:

(1)该密闭容器的容积是___。
(2)达到未平衡状态的时刻是___min(填“3”或“10”)。
(3)在前3min内,用H2浓度的变化表示的反应速率v(H2)=___mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为__。
(5)达平衡后H2O(g)的物质的量分数是___。
(6)已知:①CO(g)+2H2(g)=CH3OH(g) △H=-90.1kJ/mol,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.1kJ/mol,则CO2与H2反应合成CH3OH(g)的热化学方程式__,反应在10min内所放出的热量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“1.0 mol·L-1 NaCl溶液”的说法正确的是
A.该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B.若取该溶液50 mL,其中c(Cl-) = 0.05 mol·L-1
C.若取该溶液10 mL,恰好能与100 mL 0.1 mol·L-1 AgNO3溶液完全反应
D.该溶液与1.0 mol·L-1 Na2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂 能发生的反应有( )
能发生的反应有( )
①皂化反应 ②使高锰酸钾酸性溶液褪色 ③使溴水褪色 ④氧化反应 ⑤还原反应 ⑥加成反应
A.①⑤B.①②③④
C.①④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体a通入溶液b中(装置如图所示),始终无明显变化的是
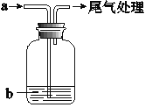
选项 | 气体a | 溶液b |
A | CO2 | CaCl2 |
B | Cl2 | KI |
C | SO2 | Ba(NO3)2 |
D | NO2 | FeSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下化学反应CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为:K=________________。
(2)写出一种加快该化学反应的反应速率的方法_____________________。
(3)该反应为_____________反应(填“吸热”或“放热”)。
(4)下列能说明该反应已达到化学平衡状态的是____________________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=2υ逆(H2O) d .c(CO2)=c(CO)
(5)某温度下,各物质的平衡浓度符合:c(CO2)c(H2)=c(CO)c(H2O),则该反应的反应温度为_______________________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C8H14O6,1mol该酯完全水解可得到2mol羧酸和1mol某常见的醇,且1mol该羧酸能与足量的钠反应放出22.4L(标准状况)H2,下列说法错误的是( )
A. 该醇是乙二醇B. 该羧酸有3种同分异构体
C. 该羧酸含有的官能团是羟基和羧基D. 该羧酸的分子式是C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。

(1)该温度下,该反应的平衡常数为___________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为________。
(3)25 min时,加入了________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_______(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com