
����Ŀ����1����25��ʱ��2mol�Ҵ���C2H5OH������������ȫȼ�շų�������Ϊ2733.6kJ��д����ʾ�Ҵ�ȼ���ȵ��Ȼ�ѧ����ʽ ��
��2�������Ҵ���ȼ�շ�Ӧ�������������������Һ���һ��ȼ�ϵ�أ���ͨ��������һ��Ϊ �����������������������������ĵ缫��ӦʽΪ ��
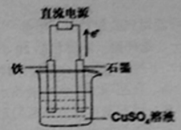
��3������ͼ��ʾװ���У�ʯī�缫�ĵ缫��ӦʽΪ �������ʼ�����CuSO4����������һ��ʱ�䣬����·��ת��1.0mol����ʱ��Ҫʹ��Һ�ָ���ԭŨ�ȣ��������м���������� ���ѧʽ����������Ϊ g��
���𰸡���1��C2H5OH(l)+3O2(g)=2CO2(g)+3H2O ��H=-1366.8kJ/mol��
��2�� C2H5OH-12e-+16OH-=2CO32-+11H2O��
��3�� 4OH- -4e-=2H2O+O2����CuO��20.0g��
��������
�����������1��ȼ������1mol��ȼ����ȫȼ�ղ����ȶ���������ʱ�ų���������������25��ʱ��2mol�Ҵ���C2H5OH������������ȫȼ�շų�������Ϊ2733.6kJ������1mol�Ҵ���ȫȼ�ղ���Һ��ˮ�Ͷ�����̼���壬�ų�������2733.6kJ��2=1366.8kJ���ʱ�ʾ�Ҵ�ȼ���ȵ��Ȼ�ѧ����ʽ��C2H5OH(l)+ 3O2(g) =2CO2(g)+3H2O(l) ��H=-1366.8kJ/mol��
��2�������Ҵ���ȼ�շ�Ӧ�������������������Һ���һ��ȼ�ϵ�أ���ͨ��������һ��Ϊ������ͨ���Ҵ��ĵ缫Ϊ�������ڼ��������¸����ĵ缫��ӦʽΪC2H5OH-12e-+16OH-=2CO32-+11H2O��
��3������ͼ��ʾװ���У�ʯī�缫ʧȥ���ӣ�����������Ӧ���õ缫�ĵ缫��ӦʽΪ4OH- -4e-=2H2O+O2����CuSO4��Һ���ķ���ʽ�ǣ�2CuSO4+2H2O ![]() 2Cu+O2�� +2H2SO4�����ݷ���ʽ��֪������Ӧת��4mol���ӣ��ᷴӦ����2mol���ᣬͬʱ����2molCu��1molO2��������Ӧ�����2molCuO�����Ե��һ��ʱ�䣬����·��ת��1.0mol����ʱ��Ҫʹ��Һ�ָ���ԭŨ�ȣ��������м����������CuO��������Ϊ1/4��80g=20.0g��
2Cu+O2�� +2H2SO4�����ݷ���ʽ��֪������Ӧת��4mol���ӣ��ᷴӦ����2mol���ᣬͬʱ����2molCu��1molO2��������Ӧ�����2molCuO�����Ե��һ��ʱ�䣬����·��ת��1.0mol����ʱ��Ҫʹ��Һ�ָ���ԭŨ�ȣ��������м����������CuO��������Ϊ1/4��80g=20.0g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)�Ͱ��ǵ������ֳ���������ڿ�ѧ�������������й㷺Ӧ�ã��ش��������⣺
(1)N2H4��Nԭ�Ӻ��������ﵽ8�����ȶ��ṹ��д��N2H4�Ľṹʽ��___________��
(2)ʵ���������ֹ�����ȡNH3�ķ�Ӧ��ѧ����ʽΪ_____________��
(3)NH3��NaClO��Ӧ�ɵõ���(N2H4)���÷�Ӧ�Ļ�ѧ����ʽΪ_____________��
(4)��һ����ȼ�ϵ����һ�ּ��Ի�����أ��õ�طŵ�ʱ�������ķ�ӦʽΪ_____________��
(5)��ҵ�������ص�ԭ������NH3��CO2Ϊԭ�Ϻϳ�����[CO(NH2)2]��Ӧ�Ļ�ѧ����ʽΪ2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
T/�� | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
���ʱ��H_________0(���������������=��)��
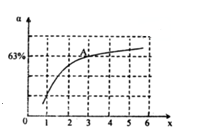
����һ���¶Ⱥ�ѹǿ�£���ԭ�����е�NH3��CO2�����ʵ���֮��(��̼��)\frac{n(NH_{3})}{n(CO_{2})}=x����ͼ�ǰ�̼��(x)��CO2ƽ��ת����(��)�Ĺ�ϵ��������x����������ԭ����_____________��ͼ��A�㴦��NH3��ƽ��ת����Ϊ___________��
(6)�ں��º����ܱ������а��ռס��ҡ������ַ�ʽ�ֱ�Ͷ�ϣ�������Ӧ��N2(g)+3H2(g)2NH3(g)����ü�������H2��ƽ��ת����Ϊ40%��
n(N2) | n(H2) | n(NH3) | |
�� | 1mol | 3mol | 0mol |
�� | 0.5mol | 1.5mol | 1mol |
�� | 0mol | 0mol | 4mol |
���ж��������з�Ӧ���еķ�����_____________(����������)�ƶ���
�ڴ�ƽ��ʱ���ס��ҡ�����������NH3�����������С˳��Ϊ_____________��
��6�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����д���÷�Ӧ�Ļ�ѧ����ʽ�� ����ѧ�����ô�ԭ������Ƴɰ���һ����ȼ�ϵ�أ���ͨ�백���ĵ缫��
��7��һ�������£�ij�ܱ������з�����Ӧ��4NH3��g��+5O2��g��![]() 4NO��g��+6H2O��g������һ��������ܱ������У�Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ������д�ʩ�пɲ��õ��� ������ĸ���ţ���
4NO��g��+6H2O��g������һ��������ܱ������У�Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ������д�ʩ�пɲ��õ��� ������ĸ���ţ���
a������ѹǿ b���ʵ������¶� c������O2��Ũ�� d��ѡ���Ч����
��8�����ij��ˮ�ĵ���̶�Ϊ1%��Ũ��Ϊ0.01 mol/LMgCl2��Һ�μ���ˮ����ʼ��������ʱ(��������Һ����仯)����Һ�е�NH3��H2O��Ũ��Ϊ {��֪Ksp[Mg(OH)2]=4.0��10-12]}
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F����Ԫ�ؾ�λ�����ڱ���ǰ�����ڣ���ԭ��������������Ԫ��A��ԭ�Ӱ뾶��С��Ԫ�أ�BԪ�ػ�̬ԭ�ӵĺ�����ӷ�ռ�ĸ�ԭ�ӹ�����ܼ�����DԪ��ԭ�ӵ��ѳɶԵ���������δ�ɶԵ���������3����E��D����ͬһ���壻Fλ��ds������ԭ�ӵ������ֻ��1�����ӡ�
��1��E+���ӵĵ����Ų�ʽ�� ��
��2��B��C��DԪ�صĵ�һ�������ɴ�С��˳���� ��
��3��B��CԪ�ص�ijЩ�⻯��ķ����о�����18�����ӣ���B�������⻯��Ļ�ѧʽ�� ��B��C����Щ�⻯��ķе����ϴ����Ҫԭ���� ��
��4��A��B��D���γɷ���ʽΪA2BD��ij�������û����������Bԭ�ӵĹ���ӻ������� ��1 mol�÷����к�����������Ŀ�� ��
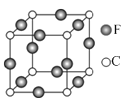
��5��C��E��Ԫ���γɵ�ij������ľ����ṹ��ͼ��ʾ����û�����Ļ�ѧʽ�� ��Cԭ�ӵ���λ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������������Ӷ����ƻ�ˮ�ĵ���ƽ�����
A��W2-��X+ B��X+�� Y3+
C��Y3+�� Z2- D��X+�� Z2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1mol X��1mol Y�����2 L���ܱ����������������·�Ӧ 2X(g)��Y(g) =nZ(g)
��2W(g)��2minĩX�����ʵ���Ϊ0.2mol����Z��Ũ�ȱ�ʾ�ķ�Ӧ����Ϊ0.1mol/��L��min��
��ش���
��1��ǰ2min��X��Ũ�ȱ�ʾ��ƽ����Ӧ����
��2��nֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1 g������ȫȼ������ˮ����ʱ�ų�����121 kJ����������1 mol O==O����ȫ����ʱ��������496 kJ��ˮ������1 mol H��O���γ�ʱ�ų�����463 kJ����������1 mol H��H������ʱ��������Ϊ
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A���������ܽ�����ʯ��CaCO3��2H+��Ca2+��H2O��CO2��
B�����Ȼ�����Һ�еμӹ�����ˮ��Al3+��4NH3��H2O��AlO��2��4NH+ 4��2H2O
C����̼�������Һ�м��������ռ���Һ��
Ca2����2HCO��3��2OH����CaCO3����CO2��3��H2O
D������������Һ�еμ����Ը��������Һ��
5SO2��3��6H+��2MnO![]() ��5SO2��4��2Mn2+ ��3H2O
��5SO2��4��2Mn2+ ��3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. þ��ȼ�տ�����CO2���
B. ����������Ҫ�İ뵼����ϣ�������������ά
C. Cl2��ʹʪ�����ɫ������ɫ������ΪCl2��������
D. �����ƿɱ�����ú����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ�����һ��ʵ�飬�ԲⶨSO2ת��ΪSO3��ת���ʣ�
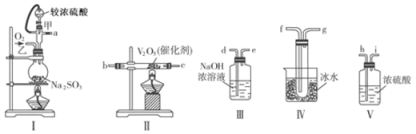
��1��д��I����70%�����������������ȡ��������Ļ�ѧ����ʽ ��
��2����Щװ�õ�����˳����������ҵķ�����a�� �� �� �� �� �� �� ��d������ӿڵı�ţ���
��3�����Ҵ�����ͨ��O2��ΪʹSO2�нϸߵ�ת���ʣ�ʵ��ʱ��������Ũ�������������ȴ������Ⱥ�˳���� ��II�з����Ļ�ѧ����ʽΪ ��
��4�������۲쵽�������� ��
��5���������ô�������ƿʱ��SO2��ת���ʻ� ���������������������������С����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com