
| A. | 1000mL水中所含K+、SO42-总数为0.15NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+的浓度为0.1mol/L | |
| D. | 1L溶液中SO42-的浓度是0.2mol/L |
分析 A.根据n=cV计算硫酸钾的物质的量,每摩尔硫酸钾含有3mol离子(2mol钾离子,1mol硫酸根离子),再根据N=nNA计算离子的数目;
B.根据n=cV计算钾离子的物质的量,再根据N=nNA计算钾离子的数目;
C.每摩尔硫酸钾含有2mol钾离子,钾离子的浓度为硫酸钾的2倍;
D.溶液是均一的,每摩尔硫酸钾含有1mol硫酸根,硫酸根离子的浓度等于硫酸钾的浓度.
解答 解:A.1L溶液中所含K+、SO42-总数为1L×0.1mol/L×3×NAmol-1=0.3NA,故A错误;
B.500mL溶液中含有K+离子数为0.5L×0.2mol/L×NAmol-1=0.1NA,故B正确;
C.0.1mol/L K2SO4溶液,每摩尔硫酸钾含有2mol钾离子,钾离子的浓度为硫酸钾的2倍,所以K+离子浓度是0.2mol/L,故C错误;
D.溶液是均一的,每摩尔硫酸钾含有1mol硫酸根,硫酸根离子的浓度等于硫酸钾的浓度为0.1mol/L,故D错误.
故选B.
点评 本题考查阿伏加德罗常数,题目难度中等,注意注意溶液是均一的,浓度与体积无关.


科目:高中化学 来源: 题型:选择题
| A. | 三处 | B. | 四处 | C. | 五处 | D. | 六处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能、氢能、风能、生物质能都属于新能源 | |
| B. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 | |
| D. | 镀层破损后,马口铁比白铁更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Be2+中电子数和质子数之比一定为1:2 | |
| B. | D216O中质量数之和是质子数之和的两倍 | |
| C. | 氮原子中质子数为7而中子数不一定为7 | |
| D. | 136C表示的碳原子质量数为13,原子序数为6,核内有7个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和一个-Cl,它的可能结构分别是(填写结构简式):CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构分别是(填写结构简式):CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
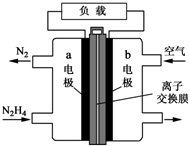 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com