
【题目】按要求回答下列问题:
(1)Na2O2与CO2的反应化学方程式____________________________________________;7.8gNa2O2固体与足量的CO2反应转移的电子数为_______________个
(2)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,请写出发生反应的离子方程式________。
(3)写出铁与水反应蒸气反应的化学方程式__________________;
(4)等体积、等浓度的碳酸氢钙溶液和氢氧化钠溶液混合的离子方程式____________;
【答案】2Na2O2+2CO2=2Na2CO3+O2 0.1NA 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O 3Fe+4H2O(g)![]() Fe3O4+4H2 Ca2++HCO3-+OH-=CaCO3↓+H2O
Fe3O4+4H2 Ca2++HCO3-+OH-=CaCO3↓+H2O
【解析】
(1)Na2O2与CO2反应生成碳酸钠和氧气,根据氧元素化合价变化情况分析反应转移的电子;
(2)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性反应生成硫酸钡、硫酸钠和水;
(3)铁和水蒸气在高温下生成四氧化三铁和氢气;
(4)根据碳酸氢钙和氢氧化钠的物质的量相等,分析其产物。
(1)Na2O2与CO2反应生成碳酸钠和氧气,该反应的方程式为2Na2O2+2CO2=2Na2CO3+O2;反应中过氧化钠中氧元素由-1价变为0价和从-1变为-2价,7.8g过氧化钠是0.1mol,则0.1molNa2O2固体与足量的CO2反应转移的电子为0.1mol,即转移电子数目为0.1NA;
(2)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,生成硫酸钡、硫酸钠和水,发生反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(3)铁和水蒸气在高温下生成四氧化三铁和氢气,该反应为3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(4)等体积、等浓度的碳酸氢钙溶液和氢氧化钠溶液混合反应生成碳酸钙、碳酸氢钠和水,反应的离子方程式为Ca2++HCO3-+OH-=CaCO3↓+H2O。


科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、蒸馏、萃取 B. 萃取、蒸发、分液
C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对反应2FeBr2+3Cl2=2FeCl3+2Br2的有关说法正确的是 ( )
A. 被氧化的元素是铁元素 B. 氧化产物是Br2
C. 还原产物是FeCl3 D. FeBr2中两种元素都被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液分别滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
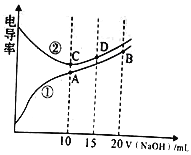
A. 曲线①代表滴定HCl溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)+c(H+)=0.1mol/L
C. 在相同温度下,A、B、C三点溶液中水的电离程度: C<B<A
D. D点溶液中:2c(Na+)=3c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是

A. 原混合物中n[Ba(OH)2]:n[NaOH] =1:2
B. 横坐标轴上p点的值为90
C. b点时溶质为NaHCO3
D. ab段发生反应的离子方程式依次为:CO2+2OH- = H2O+CO32-,CO2+H2O+ CO32-=2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
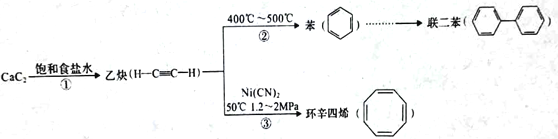
(1)反应①类似盐的水解,写出CaC2的电子式_________。
(2)苯是由哪位科学家首先发现的________,苯分子中有三个氢原子被-Br、-Br、-OH取代得到的芳香族化合物有_____种。将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,则此有机物的相对分子质量为________。
(3)写出反应③的化学反应方程式并注明反应类型__________。
(4)联二苯的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为:2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡继续通入Cl2,逆反应速率____(填增大、减少、不变)。
(2)已知几种化学键的键能数据如下表(NO的结构为:N≡O;亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol则a=______。
2ClNO(g) △H=-111kJ/mol则a=______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
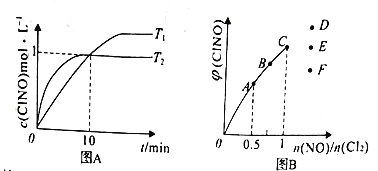
①该反应的T1______T2(填“>”<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=_______mol/(L.min)。
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是_____点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某种方法可除去下列物质中所含的少量杂质(括号内为杂质),其中加适量的盐酸能达到除杂质目的的是( )
A. NaHCO3(Na2CO3) B. NaCl(NaOH)
C. Na2SO4(Na2CO3) D. Na2CO3(NaOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在治疗创伤的中药方剂中,雄性羚羊角或犀牛角的用量极少,但是缺少这味药,疗效将大大下降甚至无效。已知动物的角主要是由死亡细胞的角化(变性)蛋白质组成的,则羚羊角等的有效成分最可能是( )
A. 特殊活性蛋白质 B. 核酸
C. 微量元素 D. 大量元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com