
| A、燃烧热只针对可燃物和氧气反应而言 |
| B、中和热只针对强酸与强碱反应而言 |
| C、溶解平衡只针对难溶物而言 |
| D、电解池只针对自发进行的氧化还原反应而言 |


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:

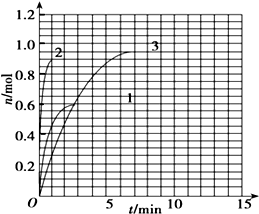 到Z随时间变化的曲线1、2、3(如图所示)则曲线1所对应的实验条件改变是:
到Z随时间变化的曲线1、2、3(如图所示)则曲线1所对应的实验条件改变是:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br- |
| B、常温下PH=1的溶液中:Fe2+、Mg2+、NO3-、Cl- |
| C、含有大量Fe3+的溶液中:SCN-、I-、K+、Br- |
| D、能使石蕊试液显红色的溶液中:K+、SO42-、S2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇的结构简式为:C2H6O |
B、硫离子的结构示意图为: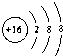 |
| C、NaHCO3电离:NaHCO3=Na++H++CO32- |
D、氮分子的结构式为: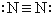 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,28g以任意比组成的CO与N2混合气体中含有2NA个原子 |
| B、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| C、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA |
| D、标准状况下,11.2L H2O与8.5gNH3所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、7d | B、5d |
| C、2.5d | D、2d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MFe2Ox是还原产物 |
| B、MFe2Ox 中+2价铁与+3价铁的物质的量之比为1:3 |
| C、x=3.5 |
| D、若反应中消耗H2(标准状况下)33.6 L,则转移电子3 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com