
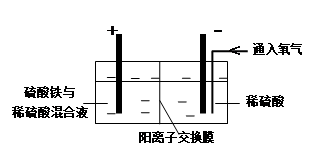
 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相) R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生(1分)
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生(1分) R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生。
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生。

科目:高中化学 来源:不详 题型:单选题
| A.电解池是电能转化为化学能的装置 |
| B.原电池跟电解池链接后,电子从原电池负极流向电解池阳极 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.用惰性电极电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔融的NaCl(阳极) | B.NaCl溶液(阴极) |
| C.NaOH溶液(阴极) | D.Na2SO4(阳极) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
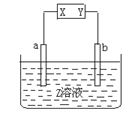
| | a极板 | b极板 | X电极 | Z溶液 |
| A | 银 | 铁 | 正极 | AgNO3 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 锌 | 石墨 | 负极 | CuSO4 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
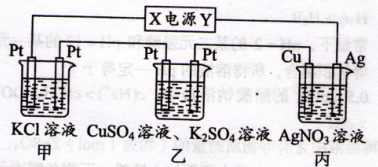
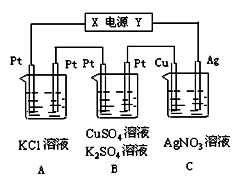
| A.乙中左侧电极反应式:Cu2++2e-=Cu |
| B.电解过程中装置丙的pH无变化 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.当甲装置中产生标准状况下4.48 L气体时,Cu电极上质量增加43.2 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
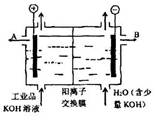
| A.阴极材料可以是Fe,含氧酸根杂质不参与电极上放电 |
| B.该电解槽的阳极反应式为:4OH―― 4e-= 2H2O+O2↑ |
| C.通电后,该电解槽阴极附近溶液pH会减小 |
| D.除去杂质后氢氧化钾溶液从出口B导出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
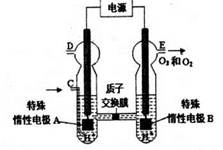
 2O3
2O3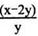 (忽略O3的分解)
(忽略O3的分解)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4 | B.MgSO4 | C.Al (NO3)3 | D.Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com