
分析 混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成.纯净物又分为单质和化合物;
单质是有同种元素组成的纯净物;
氧化物是由两种元素组成,一种元素是氧元素;
酸是水溶液中电离出的阳离子全部是氢离子的化合物;
碱是水溶液中电离出的阴离子全部是氢氧根离子的化合物;
盐是金属阳离子和酸根阴离子构成的化合物,铵盐例外.
解答 解:①空气是多种气体的混合物②溶液是分散系,都为混合物;③铜 ④氯气只有一种元素组成是单质;⑤二氧化碳 ⑥氧化钙是由两种元素组成,一种元素是氧元素,是氧化物;⑧硫酸水溶液中电离出的阳离子全部是氢离子,属于酸;⑨碳酸钠 ⑩碳酸钙是金属阳离子和酸根阴离子构成的化合物,属于盐;⑦氢氧化钠属于碱,故答案为:①②;③④;⑤⑥;⑧;⑨⑩;⑦.
点评 本题考查了物质的分类,题目难度不大,注意掌握好物质的分类依据,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥⑦⑧ | B. | ①③⑤⑦ | C. | ①③④⑥⑧ | D. | ①④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46gNO2含有2NA个分子 | |
| B. | 标准状况下,1.12L1H2和0.2g2H2均含有0.1NA个质子 | |
| C. | 室温时,1LpH=2的NH4Cl溶液中水电离出H+的数目为10-12NA | |
| D. | 过氧化氢分解制得标准状况下1.12LO2,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生反应生成CO2和H2并放出热量,CO和H2O浓度变化如图:
在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生反应生成CO2和H2并放出热量,CO和H2O浓度变化如图: CO2+H2
CO2+H2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 能导电 | 电解质 | 非电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ③⑤⑥⑨⑩ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

 ②
② ③
③ ④
④ ⑤
⑤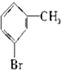
 ⑦
⑦
| A. | ①②③ | B. | ⑦ | C. | ④⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com