
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:分析 (1)依据C=$\frac{1000ρω}{M}$计算浓盐酸中HCl的物质的量浓度;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化;
(3)①根据稀释定律,稀释前后HCl的物质的量不变,据此计算需要浓盐酸的体积;
②分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度的影响;
解答 解:(1)该浓盐酸中HCl的物质的量浓度为$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,
故答案为:11.9;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl-的数目与溶液体积有关,
故答案为:BD;
(3)①设需要浓盐酸的体积为V mL,根据稀释定律,稀释前后HCl的物质的量不变,则:V×10-3L×11.9mol/L=0.5 L×0.400mol/L
解得:V=16.8
故答案为:16.8;
②I.用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,溶质的物质的量偏小,溶液浓度偏低;
故答案为:B;
II.转移浓溶液时操作不慎,有一滴液体溅出容量瓶,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低;
故答案为:B;
III.定容摇匀后,发现液面低于刻度线,属于正常 操作,溶液浓度准确,不受影响;
故答案为:C;
IV.定容时,俯视读数,所得溶液的浓度,导致溶液体积偏小,溶液浓度浓度偏高;
故答案为:A.
点评 本题考查物质的量浓度计算、一定物质的量浓度溶液配制等,难度不大,注意根据c=$\frac{n}{V}$理解溶液配制原理及进行误差分析.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化合物 | 甲 | 乙 | 丙 |
| 组成元素 | B、C | A、C | C、D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3═K++3O2-+Cl5+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHS?Na++HS- | D. | HCO3-?H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
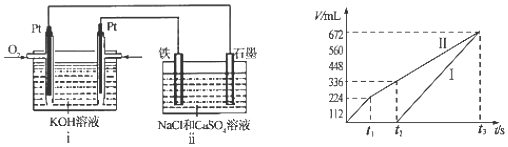
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前工业上主要采用接触法制硫酸,并使用热交换器充分利用反应中放出的热量 | |
| B. | 从海水中提取溴,是将提取粗盐后的母液浓缩、氧化,使溶液中的溴离子发生氧化反应转化成溴单质,就得到粗溴 | |
| C. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| D. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阳离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com